Слайды и текст этой онлайн презентации
Слайд 1
«Химии никоим образом научиться невозможно, не видав самой практики и, не
принимаясь за химические операции».
(М.В. Ломоносов)
Слайд 2
1. гОРЕНИЕ УГЛЯ – ЭТО ФИЗИЧЕСКОЕ ЯВЛЕНИЕ. 2.СКИСАНИЕ МОЛОКА – ЭТО ХИМИЧЕСКОЕ ЯВЛЕНИЕ. 3.ДИФФУЗИЯ ПАРОВ ДУХОВ – ЭТО ФИЗИЧЕСКОЕ. ЯВЛЕНИЕ. 4.НАГРЕВАНИЕ МЕДНОЙ ПРОВОЛОКИ В ПЛАМЕНИ. СПИРТОВКИ – ЭТО ФИЗИЧЕСКОЕ ЯВЛЕНИЕ.
Слайд 3
Тема урока:
«Химические реакции. Признаки химических реакций и условия протекания»
Слайд 4
Инструктаж по технике безопасности
При выполнении опытов следует соблюдать аккуратность.
Нельзя брать вещества руками. Для этого есть пинцет или химическая ложка.
Реактивы в пробирку следует наливать не более 1-2 мл.
Пробирку с реагирующими веществами следует держать на уровне глаз, отвёрнутой от соседа.
5.
Слайд 5
Эти образования на озере Моно (США) называют туфовые башни. Они образовались в результате реакций между карбонатами озёрной воды и кальцием из подземных источников. Продукт реакции - известняк (CaCO3).
Слайд 6
Запишите уравнение реакции
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
Признак: выпадение осадка.
Слайд 7
Запишите уравнение реакции
СаСО3+Н2SО4=СаSО4+Н2О+СО2
Признаки: растворение осадка,
выделение газа.
Слайд 8
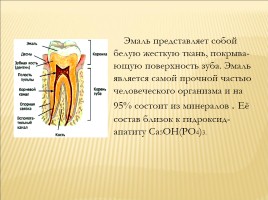
Эмаль представляет собой белую жесткую ткань, покрыва-
ющую поверхность зуба. Эмаль
является самой прочной частью
человеческого организма и на 95% состоит из минералов . Её
состав близок к гидроксид-апатиту Ca5OH(PO4)3.
Слайд 9
Под действием молочной кислоты, образующейся в ротовой полости, растворение, а затем и разрушение эмали ускоряется! Поэтому всегда после еды необходимо чистить зубы и язык, а также полоскать рот.
Слайд 10
Реакцию с признаками выделения
углекислого газа - СО2 мы наблюдаем
при брожении опары дрожжевого теста.
Слайд 11
Благодаря данной реакции, изделия
из такого теста получаются пышными
и вкусными.
Слайд 13
Запишите уравнение реакции
FeCl3+3KSCN=Fe(SCN)3+3KCl
Признак: изменение окраски.
Слайд 14
Огромное количество энергии в виде тепла и света выделяется при извержении вулканов.
Слайд 15
Самостоятельная работа
Люди мира! Воздух, которым вы дышите, состоит из смеси двух газов – азота и кислорода. Кислород – очень деятельный газ. При повышенной температуре он стремится соединиться со многими телами нашей Земли. Эта реакция хорошо известна как горение. Когда горит уголь, вещество его соединяется с кислородом, при этом выделяется тепло.
Соединение многих тел с кислородом сопровождается выделением тепла; выражаясь научно, является реакцией экзотермической. Но не все тела таковы. Есть соединения с кислородом, образование которых требует тепла извне, есть явления холодного горения – горения, не выделяющего, а поглащающего тепло. Таким холодным горением было до сих пор соединение двух газов нашего воздуха – азота и кислорода. Эта реакция эндотермическая, она требовала затраты значительной энергии и потому была редка на Земле . Она происходила в природе во время грозовых электрических разрядов – во время ударов молнии.
Слайд 16
Реакции, протекающие с выделением теплоты и света, называют реакциями горения Реакции, протекающие с выделением теплоты – экзотермические Реакции, протекающие с поглощением теплоты – эндотермические
Слайд 17
Запишите уравнения реакции
(NH4)2Cr2O7=N2 +Cr2O3+4H2O
Признак: выделение тепла и света.
Слайд 18
Условия протекания химических реакций
1. Соприкосновение
2.Нагревание
Слайд 19
Рефлексия.
Теперь я знаю, что …
2. Теперь я знаю как …
3. Теперь я умею …
Слайд 20
Всем спасибо за сотрудничество и плодотворный труд!
До новых встреч!
 Скорость протекания химических реакций
Скорость протекания химических реакций Практическая работа №1 «Закономерности протекания химических реакций»
Практическая работа №1 «Закономерности протекания химических реакций» Практическая работа № 1. Изучение влияния условий проведения химической реакции на её скорость
Практическая работа № 1. Изучение влияния условий проведения химической реакции на её скорость Роль воды в химических реакциях
Роль воды в химических реакциях Типы химических реакций
Типы химических реакций Классификация химических реакций
Классификация химических реакций Повторение «Типы химических реакций»
Повторение «Типы химических реакций»