Презентация - Свойства паров
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 89%
- Слайдов: 40
- Просмотров: 5742
- Скачиваний: 2697
- Размер: 8.13 MB
- Класс: 10
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Презентация для урока на тему:
Свойства паров, жидкостей и твёрдых тел
Дисциплина : Физика
ОГБПОУ «РПТК»
Подготовила: преподаватель физики Бирюкова Татьяна Ивановна
1/40
ОГБПОУ «РПТК»
Подготовила: преподаватель физики Бирюкова Татьяна Ивановна
1/40
Слайд 2

2/40
Содержание
Введение.......................................................................................... 3
Строение газообразных, жидких и твердых тел.............................. 4
Газы.................................................................................................. 5
Жидкости.......................................................................................... 7
Водяной пар .................................................................................... 13
Критическая температура................................................................. 16
Измерительные приборы.................................................................. 17
Твёрдое состояние, кристаллы......................................................... 22
Фазовые переходы веществ.............................................................. 29
Деформации..................................................................................... 30
Пластичность, хрупкость, упругость................................................. 33
Смачиваемость, несмачиваемость.................................................... 36
Капиллярность.................................................................................. 38
Заключение....................................................................................... 39
Ресурсы............................................................................................. 40
Содержание
Введение.......................................................................................... 3
Строение газообразных, жидких и твердых тел.............................. 4
Газы.................................................................................................. 5
Жидкости.......................................................................................... 7
Водяной пар .................................................................................... 13
Критическая температура................................................................. 16
Измерительные приборы.................................................................. 17
Твёрдое состояние, кристаллы......................................................... 22
Фазовые переходы веществ.............................................................. 29
Деформации..................................................................................... 30
Пластичность, хрупкость, упругость................................................. 33
Смачиваемость, несмачиваемость.................................................... 36
Капиллярность.................................................................................. 38
Заключение....................................................................................... 39
Ресурсы............................................................................................. 40
Слайд 3

На поверхности земли мы наблюдаем H2O в трёх агрегатных состояниях: водя-ной пар, лёд, вода. Из всех разделов физики только молекулярная физика даёт возможность показать почему вещество может находиться в газообразном, жидком и твердом состояниях.
Введение
Водяной пар
Вода
Лёд
3/40
Введение
Водяной пар
Вода
Лёд
3/40
Слайд 4
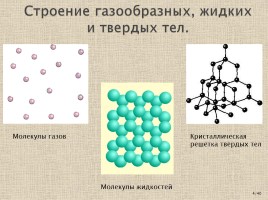
Строение газообразных, жидких и твердых тел.
Молекулы жидкостей
Молекулы газов
Кристаллическая решётка твёрдых тел
4/40
Молекулы жидкостей
Молекулы газов
Кристаллическая решётка твёрдых тел
4/40
Слайд 5

В газах расстояние между атомами и молекулами в среднем во много раз больше размеров самих молекул. Газы легко сжимаемы, при этом уменьшается среднее расстояние между молекулами, но молекулы не сдавливают друг друга. Они могут неограниченно расширятся. Они не cохраняют ни формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.[1]
Газообразное состояние
Они не сохраняют не формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
5/40
Газообразное состояние
Они не сохраняют не формы, ни объема. Многочисленные удары молекул о стенки сосуда создают давление газа.
5/40
Слайд 6

Объём и форму не сохраняют.
Расстояние между молекулами большое, во много раз больше самих молекул .
Легко сжимаемы.
Молекулы газов совершают беспорядочное движение, поэтому заполняют собой весь предоставленный им объём.
При повышении температуры расширяются. Если сосуд отсутствует, то расширяются неогра-ниченно.
Свойства газов
6/40
Свойства газов
6/40
Слайд 7

Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекулы жидкости ведет себя иначе чем молекулы. Зажатая, как в клетке, другими молекулами, она совершает «бег на месте» (колеблется около положения равновесия, сталкиваясь с соседними молекулами). Жидкость не сохраняют формы. Время оседлой жизни молекулы воды т.е. время колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем 10-11 [2]
Жидкое состояние
7/40
Жидкое состояние
7/40
Слайд 8
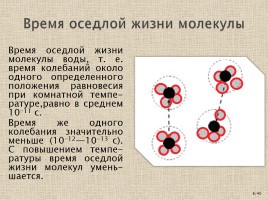
Время оседлой жизни молекулы воды, т. е. время колебаний около одного определенного положения равновесия при комнатной темпе-ратуре,равно в среднем 10-11 с.
Время же одного колебания значительно меньше (10-12—10-13 с). С повышением темпе-ратуры время оседлой жизни молекул умень-шается.
Время оседлой жизни молекулы
8/40
Время оседлой жизни молекулы
8/40
Слайд 9

Испаре́ние — процесс фазового перехода вещества из жидкого состояния в парообразное или газообразное, происходящий на поверхности вещества. Процесс испарения является обратным процессу конденсации (переход из парообразного состояния в жидкое). При испарении с поверхности жидкости (испарение жидкости) или твёрдого тела (сублимация или возгонка) вылетают (отрываются) частицы (молекулы, атомы), при этом Ek > Ер.
Рассмотрим данный процесс на молекулярном уровне: молекулы, обладающие достаточной энергией (скоростью) для преодоления притяжения соседних молекул (то есть самые быстрые),
Испарение
9/40
вещества (жидкости). При этом средняя энергия оставшихся молекул становится меньше (жидкость остывает). Например, очень горячая жидкость: мы дуем на её поверхность, чтобы остудить, при этом мы ускоряем процесс испарения. Важным фактором является также площадь поверхности жидкости, с которой происходит испарение: из узкого стакана оно будет происходить медленнее, чем из широкой тарелки.
вырываются за границы
Испарение
9/40
вещества (жидкости). При этом средняя энергия оставшихся молекул становится меньше (жидкость остывает). Например, очень горячая жидкость: мы дуем на её поверхность, чтобы остудить, при этом мы ускоряем процесс испарения. Важным фактором является также площадь поверхности жидкости, с которой происходит испарение: из узкого стакана оно будет происходить медленнее, чем из широкой тарелки.
вырываются за границы
Слайд 10

10/40
Испарение твердого тела называется сублимацией (возгонкой), а парообразование в объёме жидкости — кипением. Испарение — эндотермический процесс, при котором поглощается теплота фазового перехода — теплота испарения, затрачиваемая на преодоление сил молекулярного сцепления в жидкой фазе и на работу расширения при превращении жидкости в пар.
Сублимация(возгонка)
Вывешенное на мороз влажное белье через несколько минут замерзает и становится жестким как лист картона или фанеры. Однако через двое-трое суток оно уже совершенно свободно от льда – мягкое, эластичное и практически сухое. Лед перешел из твердой кристаллической фазы непосредственно в пар, минуя плавление. Такое «сухое» испарение называется сублимацией, или возгонкой. Сублимация льда возможна практически при любой отрицательной температуре, но при одном условии: влажность воздуха должна быть достаточно низкой. Сублимация происходит с поглощением теплоты, причем для некоторых веществ теплота сублимации весьма велика.
Испарение твердого тела называется сублимацией (возгонкой), а парообразование в объёме жидкости — кипением. Испарение — эндотермический процесс, при котором поглощается теплота фазового перехода — теплота испарения, затрачиваемая на преодоление сил молекулярного сцепления в жидкой фазе и на работу расширения при превращении жидкости в пар.
Сублимация(возгонка)
Вывешенное на мороз влажное белье через несколько минут замерзает и становится жестким как лист картона или фанеры. Однако через двое-трое суток оно уже совершенно свободно от льда – мягкое, эластичное и практически сухое. Лед перешел из твердой кристаллической фазы непосредственно в пар, минуя плавление. Такое «сухое» испарение называется сублимацией, или возгонкой. Сублимация льда возможна практически при любой отрицательной температуре, но при одном условии: влажность воздуха должна быть достаточно низкой. Сублимация происходит с поглощением теплоты, причем для некоторых веществ теплота сублимации весьма велика.
Слайд 11

Сублимация в кометах
При приближении кометы Галлея к Солнцу с поверхности её ядра начинают сублимироваться летучие вещества с малой температурой кипения, такие как вода, моноксид, оксид углерода, метан, азот и, возможно, другие замёрзшие газы. Этот процесс приводит к образованию хвоста кометы, которая может в поперечнике достигать 100 000 км. Испарение этого грязного льда высвобождает пылевые частицы, которые относятся газом от ядра. Молекулы газов в коме поглощают солнечный свет и переизлучают его затем на разных длинах волн (это явление называется флуоресценцией), а пылевые частицы рассеивают солнечный свет в различных направлениях без изменения длины волны. Оба эти процесса приводят к тому, что кома становится видимой для стороннего наблюдателя.
11/40
При приближении кометы Галлея к Солнцу с поверхности её ядра начинают сублимироваться летучие вещества с малой температурой кипения, такие как вода, моноксид, оксид углерода, метан, азот и, возможно, другие замёрзшие газы. Этот процесс приводит к образованию хвоста кометы, которая может в поперечнике достигать 100 000 км. Испарение этого грязного льда высвобождает пылевые частицы, которые относятся газом от ядра. Молекулы газов в коме поглощают солнечный свет и переизлучают его затем на разных длинах волн (это явление называется флуоресценцией), а пылевые частицы рассеивают солнечный свет в различных направлениях без изменения длины волны. Оба эти процесса приводят к тому, что кома становится видимой для стороннего наблюдателя.
11/40
Слайд 12
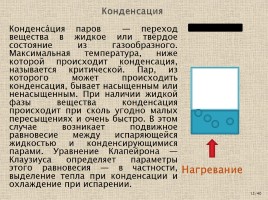
Конденса́ция паров — переход вещества в жидкое или твёрдое состояние из газообразного. Максимальная температура, ниже которой происходит конденсация, называется критической. Пар, из которого может происходить конденсация, бывает насыщенным или ненасыщенным. При наличии жидкой фазы вещества конденсация происходит при сколь угодно малых пересыщениях и очень быстро. В этом случае возникает подвижное равновесие между испаряющейся жидкостью и конденсирующимися парами. Уравнение Клапейрона — Клаузиуса определяет параметры этого равновесия — в частности, выделение тепла при конденсации и охлаждение при испарении.
Конденсация
Нагревание
12/40
Конденсация
Нагревание
12/40
Слайд 13

Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Жидкость в закрытом сосуде вначале будет испаряться и плотность пара над ней будет увеличиваться. Однако чем больше молекул покидает жидкость, тем больше возвращаются. Чем больше плотность пара, тем больше молекул возвращаются в жидкость. При постоянной температуре в закрытом сосуде в результате установится динамическое равновесие т.е в среднем, количество молекул, покинувших жидкость, равно количеству молекул, вернувшихся в жидкость.
Насыщенный пар (водяной)
13/40
Насыщенный пар (водяной)
13/40
Слайд 14

Если изменить объём насыщенного пара, то равновесие нарушится, но со временем плотность пара, а следовательно и концентрация молекул, вернутся в прежнее значение – это значит, что плотность пара и концентрация молекул в насыщенном паре не зависят от его объёма.
Давление, при котором насыщенный пар находится в динамическом равновесии со своей жидкостью называется давление насыщенного пара
pо=nkT
14/40
pо=nkT
14/40
Слайд 15

Кипе́ние — процесс интенсивного паро- образования, который происходит как со свободной поверхности жидкости, так и внутри неё. При этом в объёме жидкости возникают границы разделения фаз, то есть на стенках сосуда образуются пузырьки, которые содержат воздух и насыщенный пар. Кипение, как и испарение, является одним из способов парообразования. В отличии от испарения, кипение может происходить лишь при определённой температуре и давлении. Температура, при которой происходит кипение жидкости, находящейся под постоянным давлением, называется температурой кипения. Как правило, температура кипения при нормальном атмосферном давлении приводится как одна из основных характеристик химически чистых веществ.
Кипение
Водород -253℃
Спирт 78℃
Вода 100℃
Ртуть 357℃
Температура кипения некоторых веществ
Температура кипения жидкостей зависит от внешнего давления , чем оно больше, тем больше температура кипения.
15/40
Кипение
Водород -253℃
Спирт 78℃
Вода 100℃
Ртуть 357℃
Температура кипения некоторых веществ
Температура кипения жидкостей зависит от внешнего давления , чем оно больше, тем больше температура кипения.
15/40
Слайд 16
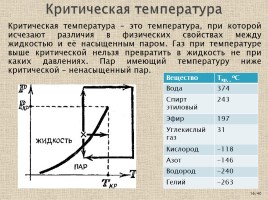
Критическая температура – это температура, при которой исчезают различия в физических свойствах между жидкостью и её насыщенным паром. Газ при температуре выше критической нельзя превратить в жидкость не при каких давлениях. Пар имеющий температуру ниже критической – ненасыщенный пар.
Критическая температура
Вещество Ткр, , оС
Вода 374
Спирт этиловый 243
Эфир 197
Углекислый газ 31
Кислород -118
Азот -146
Водород -240
Гелий -263
16/40
Критическая температура
Вещество Ткр, , оС
Вода 374
Спирт этиловый 243
Эфир 197
Углекислый газ 31
Кислород -118
Азот -146
Водород -240
Гелий -263
16/40
Слайд 17

17
17/40
17/40
Слайд 18

Психрометр состоит из двух термометров. Резервуар одного из них остается сухим, и он показывает температуру воздуха. Резервуар другого окружен полоской ткани, конец которого опущен в воду.
Вода испаряется и благодаря этому термометр охлаждается. Чем больше относительная влажность, тем менее интенсивно идет испарение и тем более высокую температуру показывает термометр, окруженный полоской ткани.
При относительной влажности, равной 100%, вода вообще не будет испаряться ( испарение равно конденсации) и показания обоих термометров будут одинаковы.
18/40
18/40
Слайд 19

Жидкостные термометры основаны на принципе изменения объёма жидкости, которая залита в термометр (обычно это спирт или ртуть), при изменении температуры окружающей среды.
Прибор измерения температур - термометр
Для непосредственного кипячения требуется нагреть жидкость до определенной температуры. А что такое температура? Это степень нагретости тела (холодное теплое горячее ). Прибор измеряющий температуру тела, воздуха или жидкости называется термометр. Все знают простые разновидности термометров:
В связи с запретом применения ртути во многих областях деятельности ведется поиск альтернативных наполнений для бытовых термометров. Например, такой заменой может стать сплав галинстан.
19/40
Прибор измерения температур - термометр
Для непосредственного кипячения требуется нагреть жидкость до определенной температуры. А что такое температура? Это степень нагретости тела (холодное теплое горячее ). Прибор измеряющий температуру тела, воздуха или жидкости называется термометр. Все знают простые разновидности термометров:
В связи с запретом применения ртути во многих областях деятельности ведется поиск альтернативных наполнений для бытовых термометров. Например, такой заменой может стать сплав галинстан.
19/40
Слайд 20

Виды гидрометров:
Весовой (абсолютный) гигрометр состоит из системы U-образных трубок, наполненных гигроскопическим веществом, способным поглощать влагу из воздуха. Через эту систему насосом протягивают некоторое количество воздуха, влажность которого определяют. Зная массу системы до и после измерения, а также объём пропущенного воздуха, находят абсолютную влажность.
В электролитическом гигрометре пластинку из электроизоляционного материала (стекло, полистирол) покрывают гигроскопическим слоем электролита — хлористого лития — со связующим материалом. При изменении влажности воздуха меняется концентрация электролита, а следовательно, и его сопротивление; недостаток этого гигрометра — зависимость показаний от температуры.
Гидрометр
20/40
Гидрометр
20/40
Слайд 21

Плёночный гигрометр имеет чувствительный элемент из органической плёнки, которая растягивается при повышении влажности и сжимается при понижении. Изменение положения центра плёночной мембраны передаётся стрелке. Волосной и плёночный гигрометр в зимнее время являются основными приборами для измерения влажности воздуха. Показания волосного и плёночного гигрометра периодически сравниваются с показаниями более точного прибора — психрометра, который также применяется для измерения влажности воздуха.
Действие волосного гигрометра основано на свойстве обезжиренного волоса, способного изменять свою длину при изменении влажности воздуха, что позволяет измерять относительную влажность от 30 до 100 %. Волос натянут на металлическую рамку. Изменение длины волоса передаётся стрелке, перемещающейся вдоль шкалы.
21/40
Действие волосного гигрометра основано на свойстве обезжиренного волоса, способного изменять свою длину при изменении влажности воздуха, что позволяет измерять относительную влажность от 30 до 100 %. Волос натянут на металлическую рамку. Изменение длины волоса передаётся стрелке, перемещающейся вдоль шкалы.
21/40
Слайд 22

Жидкости в твердом состоянии сохраняют и объем и форму. Потому что в твердом состоянии имеет кристаллическую решетку, от нее и зависит геометрическая форма.
Кристаллы - это твердые тела имеющие форму правильных многогранников. Кристаллы могут принимать форму различных призм основанием которых могут быть правильный треугольник, квадрат, параллелограмм и шестиугольник.
Твердые состояние
22/40
Твердые состояние
22/40
Слайд 23

Механическую прочность твердых тел, т.е. их способность противодейст-вовать изменению формы и объема. Между атомами есть силы притяжение и отталкивания, это и спо-собствует их твердости. Недеформируемых тел в природе не существует. если наступить на кирпич, то он тоже деформируется, высота изменится 1/20000 см.
Механические свойства твердых тел
23/40
Механические свойства твердых тел
23/40
Слайд 24

Монокристалл — отдельный однородный кристалл, имеющий непрерывную кристаллическую решётку и иногда имеющий анизотропию физических свойств. Внешняя форма монокристалла обусловлена его атомно-кристаллической решёткой и условиями (в основном скоростью и однородностью) кристаллизации. Медленно выращенный монокристалл почти всегда приобретает хорошо выраженную естественную огранку, в неравновесных условиях (средняя скорость роста) кристаллизации огранка проявляется слабо. При ещё большей скорости кристаллизации вместо монокристалла образуются однородные поликристаллы и поликристаллические агрегаты, состоящие из множества различно ориентированных мелких монокристаллов. Для них характерна анизотропия.
Монокристаллы
Кристалл поваренной соли
Алмаз в материнской породе
24/40
Монокристаллы
Кристалл поваренной соли
Алмаз в материнской породе
24/40
Слайд 25

Зависимость физических свойств от направления в кристалле называют анизотропией. Все кристаллические тела анизотропны.
Анизотропия
Анизотропия является характерным свойством кристаллических тел (точнее — лишь тех, кристаллическая решетка которых не обладает высшей — кубической симметрией). При этом свойство анизотропии в простейшем виде проявляется только у монокристаллов.
Слои кристаллической решётки графита
Поликристалл железа(срез)
У поликристаллов анизотропия тела в целом (макроскопически) может не проявляться вследствие беспорядочной ориентировки микрокристаллов, или даже не проявляется, за исключением случаев специальных условий кристаллизации, специальной обработки и т. п.
25/40
Анизотропия
Анизотропия является характерным свойством кристаллических тел (точнее — лишь тех, кристаллическая решетка которых не обладает высшей — кубической симметрией). При этом свойство анизотропии в простейшем виде проявляется только у монокристаллов.
Слои кристаллической решётки графита
Поликристалл железа(срез)
У поликристаллов анизотропия тела в целом (макроскопически) может не проявляться вследствие беспорядочной ориентировки микрокристаллов, или даже не проявляется, за исключением случаев специальных условий кристаллизации, специальной обработки и т. п.
25/40
Слайд 26

Поликристалл — агрегат мелких кристаллов какого-либо вещества, иногда называемых из-за непра-вильной формы кристал-литами или кристалли-ческими зёрнами. Многие материалы естественного и искусственного происхож-дения (минералы, металлы, сплавы, керамики и т. д.) являются поликристаллами.
Поликристаллы
Поликристалл висмута
26/40
Поликристаллы
Поликристалл висмута
26/40
Слайд 27
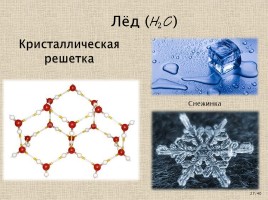
Лёд ( )
Кристаллическая решетка
Снежинка
27/40
Кристаллическая решетка
Снежинка
27/40
Слайд 28

Кристаллическая решетка
Натрий хлорид (Поваренная соль)
Внешний вид
28/40
Натрий хлорид (Поваренная соль)
Внешний вид
28/40
Слайд 29
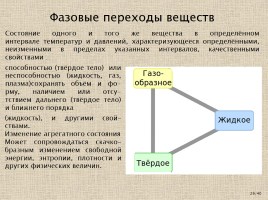
Фазовые переходы веществ
Состояние одного и того же вещества в определённом интервале температур и давлений, характеризующееся определёнными, неизменными в пределах указанных интервалов, качественными свойствами :
способностью (твёрдое тело) или неспособностью (жидкость, газ, плазма)сохранять объём и фо-рму, наличием или отсу-тствием дальнего (твёрдое тело) и ближнего порядка
(жидкость), и другими свой-ствами. Изменение агрегатного состояния Может сопровождаться cкачко-бразным изменением свободной энергии, энтропии, плотности и других физических величин.
29/40
способностью (твёрдое тело) или неспособностью (жидкость, газ, плазма)сохранять объём и фо-рму, наличием или отсу-тствием дальнего (твёрдое тело) и ближнего порядка
(жидкость), и другими свой-ствами. Изменение агрегатного состояния Может сопровождаться cкачко-бразным изменением свободной энергии, энтропии, плотности и других физических величин.
29/40
Слайд 30

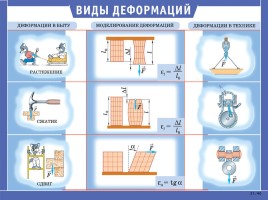
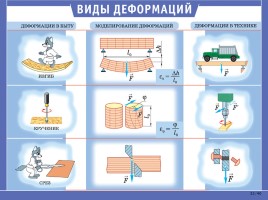
Разновидности деформации
Упругие деформации исчезают после окончания действия приложенных сил. В основе упругих деформаций лежат обратимые смещения атомов металлов от положения равновесия (другими словами, атомы не выходят за пределы межатомных связей);
Пластические деформации — это необратимые деформации, выз-ванные изменением напряжений. При пластической деформации металла одновременно с изменением формы меняется ряд свойств — в частности, при холодном деформировании повышается прочность.
30/40
Упругие деформации исчезают после окончания действия приложенных сил. В основе упругих деформаций лежат обратимые смещения атомов металлов от положения равновесия (другими словами, атомы не выходят за пределы межатомных связей);
Пластические деформации — это необратимые деформации, выз-ванные изменением напряжений. При пластической деформации металла одновременно с изменением формы меняется ряд свойств — в частности, при холодном деформировании повышается прочность.
30/40
Слайд 31
31/40
Слайд 32
32/40
Слайд 33

Пласти́чность — способность материала без разрушения получать большие остаточные деформации. К числу весьма пластичных материалов относятся отожженная медь, алюминий, латунь, золото, малоуглеродистая сталь и др.
Пластичность
отожженная медь
Латунь
Алюминий
Золото
Битум ( в нагретом виде)
33/40
Пластичность
отожженная медь
Латунь
Алюминий
Золото
Битум ( в нагретом виде)
33/40
Слайд 34

Хрупкость — свойство материала разрушаться без образования заметных остаточных деформаций. Является противоположным свойству пластичности. Материалы, обладающие этим свойством, называются хрупкими. Для таких материалов удлинение при разрыве не превышает 2…5 %, а в ряде случаев измеряется долями процента. К хрупким материалам относятся чугун, высокоуглеродистая инструментальная сталь, стекло, кирпич, камни и др.
Хрупкость
Разбитое стекло
Кирпич
Разбитый горшок
34/40
Хрупкость
Разбитое стекло
Кирпич
Разбитый горшок
34/40
Слайд 35
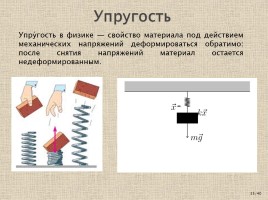
Упругость
Упру́гость в физике — свойство материала под действием механических напряжений деформироваться обратимо: после снятия напряжений материал остается недеформированным.
35/40
Упру́гость в физике — свойство материала под действием механических напряжений деформироваться обратимо: после снятия напряжений материал остается недеформированным.
35/40
Слайд 36

Молекулы жидкости притягиваются друг у кругу слабее, чем к молекулам твердого тела. В результате жидкость стремится прижаться к поверхности, расплывается по ней. Так ведет себя ртуть на цинковой пластине, вода на чистом стекле или дереве .В этом случае говорят, что жидкость смачивает поверхность.
Смачивание
36/40
Смачивание
36/40
Слайд 37

Молекулы жидкости притягиваются друг у кругу сильнее, чем к молекулам твердого тела. В результате силы притяжения между молекулами жидкости собирают её в капельку. Так ведет себя ртуть на стекле, вода на парафине или "жирной" поверхности. В этом случае говорят, что жидкость НЕ смачивает поверхность.
Не смачивание
37/40
Не смачивание
37/40
Слайд 38

капиллярный эффект — физическое явление, заключающееся в способности жидкостей изменять уровень в трубках, узких каналах произвольной формы, пористых телах. В поле тяжести (или сил инерции, например при центрифугировании пористых образцов) поднятие жидкости происходит в случаях смачивания каналов жидкостями, например воды в стеклянных трубках, песке, грунте и т. п. Понижение жидкости происходит в трубках и каналах, не смачиваемых жидкостью, например ртуть в стеклянной трубке.
Капиллярность
38/40
Капиллярность
38/40
Слайд 39

С газообразными, жидкими и твёрдыми телами мы сталкиваемся ежедневно: мы пьём воду, мы дышим воздухом (в котором содержится водяной пар), который является газом, и контактируем с твёрдыми телами с самого рождения, катаясь на ледяных горках. Очень важно знать: что из себя представляют эти вещества, их свойства и явления связанные с ними. Эти знания облегчают нашу жизнь в разы, и делают её комфортной. В этой скромной но емкой презентации мы рассказали о некоторых свойствах газов, жидкостей и твёрдых тел.
Заключение
Всего доброго, спасибо за внимание!
39/40
Заключение
Всего доброго, спасибо за внимание!
39/40
Слайд 40

[1] – Физика 10 класс. Авторы : Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. и д.р. 2012 год издания.
[2] – Википедия :http://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%B3%D0%BB%D0%B0%D0%B2%D0%BD%D0%B0%D1%8F_%D1%81%D1%82%D1%80%D0%B0%D0%BD%D0%B8%D1%86%D0%B0
Все картинки взяты из : http://yandex.ru/images/?redircnt=1403853641.1&uinfo=sw-1366-sh-768-ww-1349-wh-667-pd-1-wp-16x9_1366x768
Ресурсы
40/40
Ресурсы
40/40
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.