Слайды и текст этой онлайн презентации
Слайд 1
Состав ядра атома. Изотопы. Химический элемент.
Слайд 2
Демокри́т Абдерский (Δημόκριτος; ок. 460 до н. э., Абдеры — ок. 370 до н. э.) — великий древнегреческий философ, предположительно ученик Левкиппа, один из основателей атомистики и материалистической философии.
Михаи́л Васи́льевич Ломоно́сов (8 (19) ноября 171,село Денисовка, Русское царство — 4 (15) апреля 1765, Санкт-Петербург, Российская империя) — первый русский учёный-естествоиспытатель мирового значения, энциклопедист, химик и физик;
Слайд 4
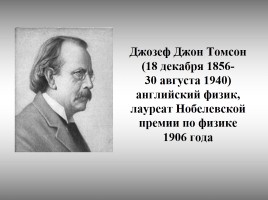
Джозеф Джон Томсон (18 декабря 1856- 30 августа 1940) английский физик, лауреат Нобелевской премии по физике 1906 года
Слайд 5
Атом, по мысли Дж. Томсона, очень похож на пудинг с изюмом: электроны, как "изюминки", а "каша" - положительно заряженное вещество атома .
Слайд 6
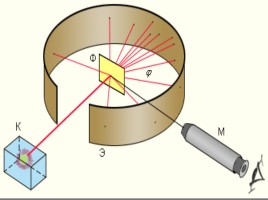
Эрнест Резерфорд (30 августа 1871 г. – 19 октября 1937 г.) Нобелевская премия по химии, 1908 год
Слайд 8
Планетарная
модель атома
Э.Резерфорда
В центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны
Слайд 11
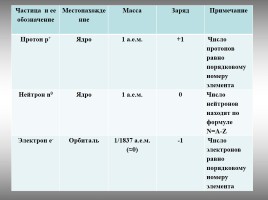
Частица и ее обозначение Местонахождение Масса Заряд Примечание
Протон p+ Ядро 1 а.е.м. +1 Число протонов равно порядковому номеру элемента
Нейтрон n0 Ядро 1 а.е.м. 0 Число нейтронов находят по формуле
N=A-Z
Электрон e- Орбиталь 1/1837 а.е.м. (≈0) -1 Число электронов равно порядковому номеру элемента
Слайд 12
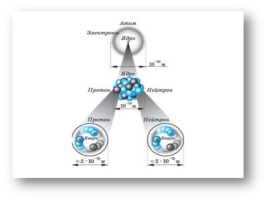
Состав ядра атома.
Слайд 14
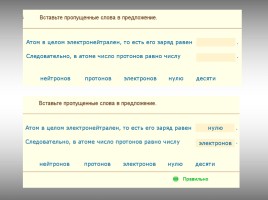
Z – порядковый номер химического элемента, указывает на заряд ядра, а следовательно на число протонов, а так как атом нейтрален, то число протонов равно числу электронов.
А – массовое число, А =Ar,
А – сумма протонов и нейтронов в ядре атома, А = Z + Nn0
Nn0 – число нейтронов
Nn0 = A - Z
Слайд 15
Порядковый Заряд Число
номер = ядра = электронов
элемента атома в атоме
Слайд 16
№ Z e p
Порядковый Заряд Число Число
номер = ядра = электронов = протонов
элемента атома в атоме в атоме
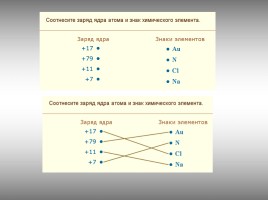
Работа в группах:
Слайд 22
Характеристика хи-мического элемента Na P AI I Au F Be
Поряд-ковый номер
Z
Число протонов N p+
Число электро-нов Ne-
Заряд ядра атома
Массовое число А
Число нейтро-
нов N n0
Слайд 23
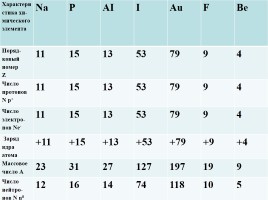
Характеристика хи-мического элемента Na P AI I Au F Be
Поряд-ковый номер
Z 11 15 13 53 79 9 4
Число протонов N p+ 11 15 13 53 79 9 4
Число электро-нов Ne- 11 15 13 53 79 9 4
Заряд ядра атома +11 +15 +13 +53 +79 +9 +4
Массовое число А 23 31 27 127 197 19 9
Число нейтро-
нов N n0 12 16 14 74 118 10 5
Слайд 26
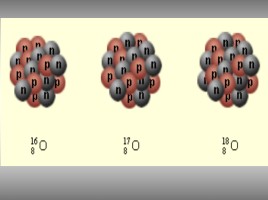
Изотопы – это разновидности атомов одного химического элемента, имеющие одинаковое число протонов и электронов, но разное число нейтронов в ядре, т.е. разные массовые числа.
Слайд 28
Аr =
Масса изотопа-1
*
распростра-ненность
+
Масса изотопа-2
*
распростра-ненность
Слайд 31
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Слайд 33
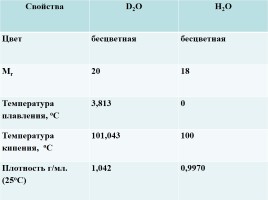
Свойства D2O H2O
Цвет бесцветная бесцветная
Мr 20 18
Температура плавления, оС 3,813 0
Температура кипения, оС 101,043 100
Плотность г/мл. (25оС) 1,042 0,9970
Слайд 34
Кто самый смелый? Работа с модулем ЭОР.
Слайд 35
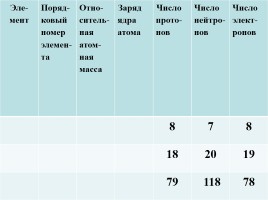
Эле-
мент Поряд-ковый номер элемен-та Отно-ситель-ная атом-ная масса Заряд ядра атома Число прото-нов Число нейтро-нов Число элект-ронов
8 7 8
18 20 19
79 118 78
Слайд 38
Рефлексия
Я узнал, что …..
Я расскажу другу, что …..
Мне было интересно узнать…..
Я оценю работу группы на ….
Я сегодня заслуженно получаю ……
Слайд 39
На дом:
§ 6, 7
упр.3, 5 с.24-25 (упр. 3 в виде таблицы)
упр.1 с. 24 ( кто умнее? )
 Тестовые задания. Химический состав клетки. Макро- и микроэлементы
Тестовые задания. Химический состав клетки. Макро- и микроэлементы Фирменный стиль и его основные составляющие. Элементы фирменного стиля
Фирменный стиль и его основные составляющие. Элементы фирменного стиля Химический состав клетки
Химический состав клетки Химический состав клетки для 5 класса по химии
Химический состав клетки для 5 класса по химии Химические элементы, названные в честь ученых
Химические элементы, названные в честь ученых Тренажёр по химии для 8 класса «Состав атома»
Тренажёр по химии для 8 класса «Состав атома» Викторина «Цветные химические элементы»
Викторина «Цветные химические элементы»