Слайды и текст этой онлайн презентации
Слайд 2
Атомы благородных газов имеют
завершённый внешний энергетический
уровень. Он наиболее устойчив и
стабилен, что является причиной
инертности атомов благородных газов.
Слайд 3
Атомы других элементов пытаются
приобрести конфигурацию ближайшего
благородного газа и перейти в
наиболее устойчивое состояние.
Такое состояние атомы приобретают,
взаимодействуя между собой, в
результате между ними возникает
химическая связь.
Слайд 4
Химическая связь – это
силы взаимодействия,
которые соединяют
отдельные атомы в
молекулы, ионы,
кристаллы.
Слайд 5
Валентность –
это способность
атома элемента образовывать
различное число химических
связей с другими атомами.
Слайд 6
Величина валентности элемента
определяется числом химических
связей,которые атом элемента образует с другими атомами.
Слайд 7
В образовании
химической связи
участвуют только
валентные электроны.
Слайд 8
У элементов главных подгрупп – это электроны
внешнего энергетического уровня. Они
расположены дальше от ядра и менее прочно
связаны с ним. В зависимости от способа
образования завершённых электронных
структур атомов различают несколько видов
химической связи.
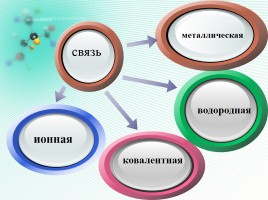
Слайд 9
Click to
add Titl
водородная
металлическая
связь
Слайд 10
В образовании ковалентной
связи принимают участие
неспаренные валентные
электроны атома, которые
располагаются на внешнем
уровне по одному.
Число неспаренных электронов =
8 – номер группы элемента
Например, у серы число неспаренных
электронов равно 8 – 6 = 2.
Слайд 11
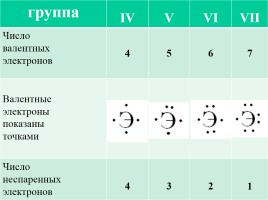
группа
IV
V
VI
VII
Число
валентных
электронов 4 5 6 7
Валентные
электроны
показаны
точками
Число
неспаренных
электронов
4
3
2
1
Слайд 12
Ковалентная связь – это
химическая связь между
атомами, осуществляемая
при помощи общих
электронных пар.
Слайд 13
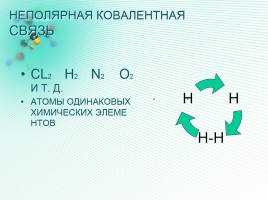
НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ
CL2 H2 N2 O2 И Т. Д.
АТОМЫ ОДИНАКОВЫХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
о
о
Слайд 14
Механизм образования
ковалентной связи
Неспаренные
электроны
Общая или поделённая
пара электронов
Между ядрами образуется сгущение
отрицательного заряда, который
притягивает к себе ядра атомов.
Слайд 15
Образование ковалентной связи
в молекуле хлора (Cl2).
+17Cl 2е- 8е- 7е-
Для завершения внешнего слоя каждому атому не хватает по 1е-.За счёт образования
ковалентной связи каждый атом в молекуле
приобретает завершённый внешний слой.
Слайд 16
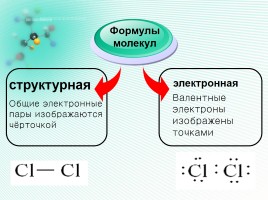
структурная
Формулы
молекул
электронная
Общие электронные
пары изображаются
чёрточкой
Валентные
электроны
изображены
точками
Слайд 17
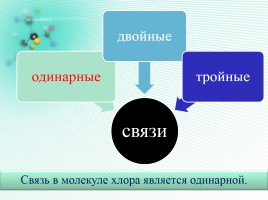
Связь в молекуле хлора является одинарной.
Слайд 18
Образование молекулы
азота (N2).
+7N 2е- 5е-
В молекуле азота образуется тройная связь, значит атом азота
трёхвалентен.
Слайд 19
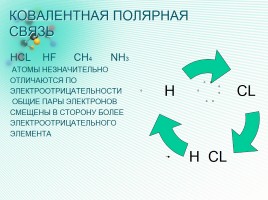
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ
HCL HF CH4 NH3
АТОМЫ НЕЗНАЧИТЕЛЬНО
ОТЛИЧАЮТСЯ ПО
ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ
ОБЩИЕ ПАРЫ ЭЛЕКТРОНОВ
СМЕЩЕНЫ В СТОРОНУ БОЛЕЕ
ЭЛЕКТРООТРИЦАТЕЛЬНОГО
ЭЛЕМЕНТА
о
о
о
о
о
о
о
о
Слайд 20
Образование молекулы
хлороводорода (HCl).
+1Н 1е-
+17Cl 2е- 8е- 7е-
Водород и хлор в молекуле хлороводорода
одновалентны, так как образуется
одинарная связь.
Слайд 21
Практическая часть.
Составьте схему строения атома
кислорода. Подчеркните валентные
электроны и обозначьте их точками
вокруг символа атома. Сколько
электронов атома кислорода могут
участвовать в образовании связей
с атомами водорода?
Слайд 22
Ответы.
+8О 2е- 6е-
Число валентных электронов равно 6,из них неспаренных - 2 (8 – 6 = 2).
В образовании связей с атомами
водорода участвуют 2 неспаренных
электрона .
 Ковалентная неполярная связь
Ковалентная неполярная связь Строение ароматических углеводородов - Ароматическая связь
Строение ароматических углеводородов - Ароматическая связь Ионная связь
Ионная связь Урок русского языка в 3 классе «Связь частей речи в словосочетаниях»
Урок русского языка в 3 классе «Связь частей речи в словосочетаниях» Взаимосвязь органов и систем органов как основа гомеостаза
Взаимосвязь органов и систем органов как основа гомеостаза Взаимосвязь русского языка и экологии
Взаимосвязь русского языка и экологии Урок математики 1 класс «Связь сложения и вычитания - Вычитание вида 8-, 9-, 10-»
Урок математики 1 класс «Связь сложения и вычитания - Вычитание вида 8-, 9-, 10-»