Презентация - Общая характеристика неметаллов
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 94%
- Слайдов: 31
- Просмотров: 5676
- Скачиваний: 2407
- Размер: 3.81 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Общая характеристика неметаллов
Общая характеристика неметаллов Общая характеристика неметаллов - Кислород, озон, воздух
Общая характеристика неметаллов - Кислород, озон, воздух Зарубежная Азия - Общая характеристика региона
Зарубежная Азия - Общая характеристика региона Общая характеристика класса пресмыкающиеся
Общая характеристика класса пресмыкающиеся Общая характеристика русской литературы первой половины XIX века
Общая характеристика русской литературы первой половины XIX века Общая характеристика, внешнее строение земноводных
Общая характеристика, внешнее строение земноводных Общая характеристика хозяйства Африки
Общая характеристика хозяйства Африки
Слайды и текст этой онлайн презентации
Слайд 1

Общая характеристика неметаллов
Слайд 2

Слайд 3

Ответьте на вопросы:
1) укажите число неметаллических элементов; 2) укажите номера групп, где расположены неметаллические элементы; 3) в каких подгруппах размещены неметаллические элементы; 4) назовите диагональные неметаллические элементы; 5) в какой части таблицы размещены неметаллические элементы. Выводы: 1) известно _______ неметаллических элементов; 2) неметаллические элементы размещены в _________________ группах; 3) неметаллические элементы размещены в _________________ подгруппах; 4) диагональные неметаллические элементы ___________________________; 5) неметаллические элементы размещены в __________________ углу таблицы над диагональю ________ .
1) укажите число неметаллических элементов; 2) укажите номера групп, где расположены неметаллические элементы; 3) в каких подгруппах размещены неметаллические элементы; 4) назовите диагональные неметаллические элементы; 5) в какой части таблицы размещены неметаллические элементы. Выводы: 1) известно _______ неметаллических элементов; 2) неметаллические элементы размещены в _________________ группах; 3) неметаллические элементы размещены в _________________ подгруппах; 4) диагональные неметаллические элементы ___________________________; 5) неметаллические элементы размещены в __________________ углу таблицы над диагональю ________ .
Слайд 4

Вывод:
В ПЕРИОДАХ СЛЕВА НАПРАВО: 1) число валентных электронов неметаллических элементов изменяется от значения _______ до значения _______; 2) высшая валентность неметаллических элементов изменяется от значения _______ до значения ______; 3) высшая степень окисления неметаллических элементов изменяется от значения _________ до значения ______________; 4) низшая степень окисления элемента определяется с помощью приема __________________________________________________________________, и изменяется от значения _________ до значения ______________; способность атомов неметаллических элементов присоединять электроны ___________________________________________; 5) некоторые исключения: __________, валентность _____ , степень окисления ___________ __________, валентность _______, степень окисления ___________, __________, валентность ______, степени окисления ___________ .
В ПЕРИОДАХ СЛЕВА НАПРАВО: 1) число валентных электронов неметаллических элементов изменяется от значения _______ до значения _______; 2) высшая валентность неметаллических элементов изменяется от значения _______ до значения ______; 3) высшая степень окисления неметаллических элементов изменяется от значения _________ до значения ______________; 4) низшая степень окисления элемента определяется с помощью приема __________________________________________________________________, и изменяется от значения _________ до значения ______________; способность атомов неметаллических элементов присоединять электроны ___________________________________________; 5) некоторые исключения: __________, валентность _____ , степень окисления ___________ __________, валентность _______, степень окисления ___________, __________, валентность ______, степени окисления ___________ .
Слайд 5

Закономерности изменения свойств
КАК ИЗМЕНЯЕТСЯ В ПЕРИОДАХ СЛЕВА НАПРАВО 1) радиус атомов элементов; 2) значение электроотрицательности элементов; 3)окислительная способность (способность присоединять электроны) неметаллических элементов; 4)активность неметаллических элементов; 5) в каком направлении в главных подгруппах Ra уменьшается,значение ЭО увеличивается, активность неметаллических элементов усиливается
КАК ИЗМЕНЯЕТСЯ В ПЕРИОДАХ СЛЕВА НАПРАВО 1) радиус атомов элементов; 2) значение электроотрицательности элементов; 3)окислительная способность (способность присоединять электроны) неметаллических элементов; 4)активность неметаллических элементов; 5) в каком направлении в главных подгруппах Ra уменьшается,значение ЭО увеличивается, активность неметаллических элементов усиливается
Слайд 6

Выводы:
В ПЕРИОДАХ СЛЕВА НАПРАВО: 1) радиус атома (Ra) ________________________________________________ 2)значение электроотрицательности (ЭО) ______________________________ 3) окислительная способность (способность присоединять электроны) 4) активность неметаллических элементов ____________________________ 5) В ГЛАВНЫХ ПОДГРУППАХ: Ra уменьшается, значение ЭО увеличивается, активность неметаллических элементов усиливается в направлении ________________________________ .
В ПЕРИОДАХ СЛЕВА НАПРАВО: 1) радиус атома (Ra) ________________________________________________ 2)значение электроотрицательности (ЭО) ______________________________ 3) окислительная способность (способность присоединять электроны) 4) активность неметаллических элементов ____________________________ 5) В ГЛАВНЫХ ПОДГРУППАХ: Ra уменьшается, значение ЭО увеличивается, активность неметаллических элементов усиливается в направлении ________________________________ .
Слайд 7

Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ.
Неметаллы характеризуются маленькими радиусами атомов и большим числом электронов на последнем энергетическом уровне ( валентных электронов). Они с трудом отдают эти электроны и легко принимают чужие.
неметаллы
неметаллы
Слайд 8

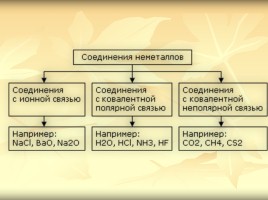
Химическая связь –ковалентная неполярная
Ковалентная неполярная связь - осуществляется посредством образования общих электронных пар между атомами одного и того же химического элемента.
Cl - Cl H - H O = O
Ковалентная неполярная связь - осуществляется посредством образования общих электронных пар между атомами одного и того же химического элемента.
Cl - Cl H - H O = O
Слайд 9

Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии
Многие неметаллы образуют молекулу, состоящую из двух атомов ( H2 , O2 , N2 , F2, Cl2 , Br2, I2) при этом образуется очень непрочная молекулярная неполярная кристаллическая решетка
He –гелий, Ne-неон , Ar-аргон , Kr-криптон , Xe-ксенон , Rn-радон
Кристаллические решётки
Есть неметаллы, образующие самые прочные атомные кристаллические решётки- алмаз (С) и кремния (Si)
Многие неметаллы образуют молекулу, состоящую из двух атомов ( H2 , O2 , N2 , F2, Cl2 , Br2, I2) при этом образуется очень непрочная молекулярная неполярная кристаллическая решетка
He –гелий, Ne-неон , Ar-аргон , Kr-криптон , Xe-ксенон , Rn-радон
Кристаллические решётки
Есть неметаллы, образующие самые прочные атомные кристаллические решётки- алмаз (С) и кремния (Si)
Слайд 10

При обычной температуре неметаллы могут быть в разном агрегатном состоянии
жидкие - Br -бром
твердые – S –сера, P-фосфор, I2 –йод, C–-алмаз и графит
газообразные- O2-кислород , H2 - водород, N2- азот , Cl2-хлор, F2-фтор.
Агрегатное состояние
жидкие - Br -бром
твердые – S –сера, P-фосфор, I2 –йод, C–-алмаз и графит
газообразные- O2-кислород , H2 - водород, N2- азот , Cl2-хлор, F2-фтор.
Агрегатное состояние
Слайд 11

Многие не проводят электрический ток (кроме графита и кремния). Не проводят тепло. В твердом состоянии- хрупкие Не имеют металлического блеска ( кроме иода-I2 , графита-C и кремния Si) Цвет охватывает все цвета спектра(красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода). Температура плавления изменяется в огромном интервале tпл (N2)= -210C , а t пл (Алмаз) =3730С
Физические свойства
Слайд 12

Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями, или модификациями.
Аллотропия
Аллотропия
Слайд 13

1. строение молекулы
пример: О2 и О3
2.строение кристаллической решетки
пример: алмаз и графит
Причины аллотропии
Причины аллотропии
Слайд 14

Аллотропные формы кислорода
Кислород образует две аллотропные модификации (причина- строение молекулы)
Кислород O2 Газ без цвета и запаха Входит в состав воздуха Не ядовит!
Озон O3 Газ бледно-фиолетового цвета с резким запахом свежести. Обладает бактерицидными свойствами , Способен удерживать ультрафиолетовые лучи
Кислород образует две аллотропные модификации (причина- строение молекулы)
Кислород O2 Газ без цвета и запаха Входит в состав воздуха Не ядовит!
Озон O3 Газ бледно-фиолетового цвета с резким запахом свежести. Обладает бактерицидными свойствами , Способен удерживать ультрафиолетовые лучи
Слайд 15

Аллотропные модификации углерода
Углерод образует две аллотропные формы (причина – строение кристаллической решётки)
Алмаз Тетраэдрическая крист. решетка Бесцветные кристаллы Самое твердое вещество в природе tпл=37300C
Графит Кристаллическая решетка напоминает соты Слоистое кристаллическое вещество Жирное на ощупь непрозрачное ,серого цвета
Углерод образует две аллотропные формы (причина – строение кристаллической решётки)
Алмаз Тетраэдрическая крист. решетка Бесцветные кристаллы Самое твердое вещество в природе tпл=37300C
Графит Кристаллическая решетка напоминает соты Слоистое кристаллическое вещество Жирное на ощупь непрозрачное ,серого цвета
Слайд 16

Аллотропные модификации фосфора
Фосфор образует семь аллотропных модификаций, причиной является строение кристаллической решётки. Наиболее известны две аллотропные модификации
Фосфор белый ( молек.кр решётка ) P4 Мягкое, бесцветное вещество В темноте светится Ядовит,!
Фосфор красный ( атомная кр.решётка) Pn аморфное полимерное вещество(порошок) в темноте не светится неядовит
Фосфор образует семь аллотропных модификаций, причиной является строение кристаллической решётки. Наиболее известны две аллотропные модификации
Фосфор белый ( молек.кр решётка ) P4 Мягкое, бесцветное вещество В темноте светится Ядовит,!
Фосфор красный ( атомная кр.решётка) Pn аморфное полимерное вещество(порошок) в темноте не светится неядовит
Слайд 17

Есть ли аллотропия у металлов?
Надо отметить, что аллотропные формы образуют не только неметаллы, но и металлы. Например, олово Sn образует две модификации белое-олово (всем известный белый очень пластичный и мягкий металл, из которого делают оловянных солдатиков) При температуре -330C белое олово превращается в серое (мелкокристаллический порошок со свойствами неметалла), этот переход называют оловянной чумой.
Надо отметить, что аллотропные формы образуют не только неметаллы, но и металлы. Например, олово Sn образует две модификации белое-олово (всем известный белый очень пластичный и мягкий металл, из которого делают оловянных солдатиков) При температуре -330C белое олово превращается в серое (мелкокристаллический порошок со свойствами неметалла), этот переход называют оловянной чумой.
Слайд 18

Химические свойства неметаллов
Проявляют сильные окислительные свойства, но многие могут выступать и как восстановители ( исключение -F2). Неметаллы образуют кислотные оксиды, кислоты и входят в состав солей в виде кислотных остатков.
Проявляют сильные окислительные свойства, но многие могут выступать и как восстановители ( исключение -F2). Неметаллы образуют кислотные оксиды, кислоты и входят в состав солей в виде кислотных остатков.
Слайд 19

Химические свойства
Неметаллы как окислители
с металлами: 2Na + Cl2 = 2NaCl; с водородом: H2 + F2 = 2HF; с неметаллами, которые имеют более низкую электроотрицательность: 2Р + 5S = Р2S5; с некоторыми сложными веществами: 4NH3 + 5O2 = 4NO + 6H2O, 2FeCl2 + Cl2 = 2 FeCl3.
Неметаллы как восстановители
(кроме фтора) S + O2 = SO2, 2H2 + O2 = 2H2О. Хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl2O, ClO2, Cl2O2), в которых хлор проявляет положительную степень окисления. со сложными веществами: ZnO + C = Zn + CO, S + 6HNO3 конц = H2SO4 + 6NO2 + 2H2О. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем и восстановителем: Cl2 + H2О = HCl + HClO.
Неметаллы как окислители
с металлами: 2Na + Cl2 = 2NaCl; с водородом: H2 + F2 = 2HF; с неметаллами, которые имеют более низкую электроотрицательность: 2Р + 5S = Р2S5; с некоторыми сложными веществами: 4NH3 + 5O2 = 4NO + 6H2O, 2FeCl2 + Cl2 = 2 FeCl3.
Неметаллы как восстановители
(кроме фтора) S + O2 = SO2, 2H2 + O2 = 2H2О. Хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl2O, ClO2, Cl2O2), в которых хлор проявляет положительную степень окисления. со сложными веществами: ZnO + C = Zn + CO, S + 6HNO3 конц = H2SO4 + 6NO2 + 2H2О. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем и восстановителем: Cl2 + H2О = HCl + HClO.
Слайд 20

Осуществите превращения: S SO3 H2SO4 CaSO4
В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов: S i, B, H, P, C, S, I, N, Cl, O, F____________
Слайд 21
Слайд 22
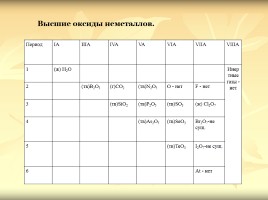
Период IA IIIA IVA VA VIA VIIA VIIIA
1 (ж) H2О Инертные газы - нет
2 (тв)B2О3 (г)CО2 (тв)N2О5 O - нет F - нет Инертные газы - нет
3 (тв)SiО2 (тв)P2О5 (тв)SО3 (ж) Cl2О7 Инертные газы - нет
4 (тв)As2О5 (тв)SeО3 Br2О7-не сущ. Инертные газы - нет
5 (тв)TeО3 I2О7-не сущ. Инертные газы - нет
6 At - нет Инертные газы - нет
Высшие оксиды неметаллов.
1 (ж) H2О Инертные газы - нет
2 (тв)B2О3 (г)CО2 (тв)N2О5 O - нет F - нет Инертные газы - нет
3 (тв)SiО2 (тв)P2О5 (тв)SО3 (ж) Cl2О7 Инертные газы - нет
4 (тв)As2О5 (тв)SeО3 Br2О7-не сущ. Инертные газы - нет
5 (тв)TeО3 I2О7-не сущ. Инертные газы - нет
6 At - нет Инертные газы - нет
Высшие оксиды неметаллов.
Слайд 23

Воздух - смесь неметаллов и их соединений.
В конце ХYlll века А.Л.Лавуазье установил, что воздух не простое вещество, а смесь газообразных неметаллов
В конце ХYlll века А.Л.Лавуазье установил, что воздух не простое вещество, а смесь газообразных неметаллов
Слайд 24

Состав воздуха
Постоянная составная часть воздуха: по объёму по массе Азот N2 78,2% 75,50% Кислород O2 20,9% 23,20% Благородные газы (в основном аргон) 0,94% 1,30%
Постоянная составная часть воздуха: по объёму по массе Азот N2 78,2% 75,50% Кислород O2 20,9% 23,20% Благородные газы (в основном аргон) 0,94% 1,30%
Слайд 25

Переменные составные части воздуха - это CO2 , H2O и О3
Случайные составные части воздуха – пыль, микроорганизмы, пыльца растений. некоторые газы, в том числе и те, которые образуют кислотные дожди(SO2,SO3,N2O5 ).
Слайд 26

Воздух, свободный от переменных и случайных составных частей, прозрачен, лишён цвета, вкуса и запаха, Мвоздуха= 29г/см3
Слайд 27

Воздух – это океан газов, на дне которого живут люди, животные и растения. Он необходим для дыхания и фотосинтеза. Растворенный в воде кислород воздуха служит для дыхания обитателей водной среды
( рыб и водных растений).
Слайд 28

ТЕСТ
1) Вставьте слова, пропущенные в тексте.
Атомы ……… в отличие от атомов……. легко принимают наружные электроны, являются …….
2) Неметаллические свойства элементов с увеличением порядкового номера в периодах …..
В группах неметаллические свойства элементов ………
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
Слайд 29

6) Какую высшую степень окисления имеют следующие элементы?
1.Азот а) +6
2.Хлор б) +5
3.Сера в) +4
4.Кремний г) +7
7) Определите, окислителем или восстановителем является сера в следующих реакциях: H2+S = H2S S — 2SO2 + O2 = 2SO3 S—
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно….. а) 4 б) 5 в) 6 г)7
7) Определите, окислителем или восстановителем является сера в следующих реакциях: H2+S = H2S S — 2SO2 + O2 = 2SO3 S—
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно….. а) 4 б) 5 в) 6 г)7
Слайд 30

9) Наиболее электроотрицательными являются атомы…..
• серы
• фосфора
• кремния
• хлора
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям: • 2, 1 • 2, 8, 2 • 2, 8, 7
10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям: • 2, 1 • 2, 8, 2 • 2, 8, 7
Слайд 31

Выполнила Гильмутдинова Людмила Михайловна.учитель химии
МБОУ «Городецкая СОШ»
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
