Презентация - Биосинтез белка
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 86%
- Слайдов: 26
- Просмотров: 4157
- Скачиваний: 1972
- Размер: 6.6 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

«БИОСИНТЕЗ БЕЛКА»
Подготовила учитель биологии МБОУ «Уллубийаульская СОШ» Мугутдинова Меседу Нюрпашаевна.
Подготовила учитель биологии МБОУ «Уллубийаульская СОШ» Мугутдинова Меседу Нюрпашаевна.
Слайд 2

Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Слайд 3

Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Слайд 4

Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Слайд 5

Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Слайд 6

Свойства белков
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Слайд 7

Строительная функция.
Белки (протеины) необходимы каждой клетке организма. Белки - структурная основа всех тканей организма. Это основной материал для построения всех клеток - от мышц и костей, до волос и ногтей.
Белки (протеины) необходимы каждой клетке организма. Белки - структурная основа всех тканей организма. Это основной материал для построения всех клеток - от мышц и костей, до волос и ногтей.
Слайд 8

Ферментативная функция.
Белки в виде ферментов, катализирующих химические реакции, участвуют в регуляции многих обменных процессов и совершенно необходимы для нормального обмена веществ в организме. Усвоение питательных веществ в организме возможно только в присутствии определенных ферментов. А ферменты - это белковые структуры, и соответственно недостаток белка приведет к серьезным нарушениям в питании организма.
Белки в виде ферментов, катализирующих химические реакции, участвуют в регуляции многих обменных процессов и совершенно необходимы для нормального обмена веществ в организме. Усвоение питательных веществ в организме возможно только в присутствии определенных ферментов. А ферменты - это белковые структуры, и соответственно недостаток белка приведет к серьезным нарушениям в питании организма.
Слайд 9

Гормональная функция.
Гормоны, регулирующие физиологические процессы, тоже являются белками. Для обеспечения нормального уровня гормонов в организме необходимо достаточное поступление протеинов. И прежде всего при гормональных нарушениях необходимо обратить внимание на достаточное поступления с пищей полноценных белков.
Гормоны, регулирующие физиологические процессы, тоже являются белками. Для обеспечения нормального уровня гормонов в организме необходимо достаточное поступление протеинов. И прежде всего при гормональных нарушениях необходимо обратить внимание на достаточное поступления с пищей полноценных белков.
Слайд 10

Защитная функция.
К белкам относятся антитела, которые связывают, нейтрализуют и способствуют выведению токсичных веществ из организма. Дефицит белка в питании уменьшает устойчивость организма к инфекциям, так как снижается уровень образования антител.
К белкам относятся антитела, которые связывают, нейтрализуют и способствуют выведению токсичных веществ из организма. Дефицит белка в питании уменьшает устойчивость организма к инфекциям, так как снижается уровень образования антител.
Слайд 11

Транспортная функция.
Белки участвуют в транспорте кровью липидов, углеводов, некоторых витаминов, гормонов, лекарственных веществ. При дефиците белка вода не удерживается в клетках и переходит в межклеточную жидкость.
Белки участвуют в транспорте кровью липидов, углеводов, некоторых витаминов, гормонов, лекарственных веществ. При дефиците белка вода не удерживается в клетках и переходит в межклеточную жидкость.
Слайд 12

Энергетическая функция.
Хотя белки и не служат главным источником энергии, тем не менее, они при определенных условиях могут выполнять эту функцию. Однако, в качестве энергетической субстанции белки очень не выгодны и требуют большое количество энергии на свое усвоение и синтез.
Хотя белки и не служат главным источником энергии, тем не менее, они при определенных условиях могут выполнять эту функцию. Однако, в качестве энергетической субстанции белки очень не выгодны и требуют большое количество энергии на свое усвоение и синтез.
Слайд 13
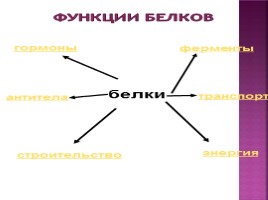
белки
транспорт
ферменты
строительство
антитела
гормоны
энергия
Функции белков
транспорт
ферменты
строительство
антитела
гормоны
энергия
Функции белков
Слайд 14

БИОСИНТЕЗ БЕЛКА
Реплика́ция ДНК — это процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты, который происходит в процессе деления клетки на матрице родительской молекулы ДНК. При этом генетический материал, зашифрованный в ДНК, удваивается и делится между дочерними клетками. Репликацию ДНК осуществляет фермент ДНК-полимераза.
Реплика́ция ДНК — это процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты, который происходит в процессе деления клетки на матрице родительской молекулы ДНК. При этом генетический материал, зашифрованный в ДНК, удваивается и делится между дочерними клетками. Репликацию ДНК осуществляет фермент ДНК-полимераза.
Слайд 15

Первооткрыватели биосинтеза белка
Франсуа Жакоб (р.1920) – французский микробиолог
Жак Люсьен Моно (1910-1976) – французский биохимик и микробиолог
Франсуа Жакоб (р.1920) – французский микробиолог
Жак Люсьен Моно (1910-1976) – французский биохимик и микробиолог
Слайд 16

Франсуа Жакоб (р.1920) – французский микробиолог
ЖАКОБ Франсуа один из авторов гипотезы переноса генетической информации и регуляции синтеза белка в бактериальных клетках (концепция оперона). Лауреат нобелевской премия за открытия, касающиеся генетического контроля синтеза ферментов и вирусов.(1965г.)
ЖАКОБ Франсуа один из авторов гипотезы переноса генетической информации и регуляции синтеза белка в бактериальных клетках (концепция оперона). Лауреат нобелевской премия за открытия, касающиеся генетического контроля синтеза ферментов и вирусов.(1965г.)
Слайд 17

Жак Люсьен Моно (1910-1976) – французский биохимик и микробиолог
Лауреат Нобелевской премии 1965 г. по физиологии и медицине «за открытия, связанные с генетическим контролем синтеза ферментов и вирусов». Его труды совместно с Ф.Жакоб и А. Львовым открыли такую область исследования, которую в полном смысле слова можно назвать молекулярной биологией.
Лауреат Нобелевской премии 1965 г. по физиологии и медицине «за открытия, связанные с генетическим контролем синтеза ферментов и вирусов». Его труды совместно с Ф.Жакоб и А. Львовым открыли такую область исследования, которую в полном смысле слова можно назвать молекулярной биологией.
Слайд 18

Транскрипция
Первый этап биосинтеза белка—транскрипция. Транскрипция— это переписывание информации с последовательности нуклеотидов ДНК в последовательность нуклеотидов РНК.
А
Т
Г
Г
А
Ц
Г
А
Ц
Т
В определенном участке ДНК под действием ферментов белки-гистоны отделяются, водородные связи рвутся, и двойная спираль ДНК раскручивается. Одна из цепочек становится матрицей для построения и-РНК. Участок ДНК в определенном месте начинает раскручиваться под действием ферментов.
матрица
ДНК
Первый этап биосинтеза белка—транскрипция. Транскрипция— это переписывание информации с последовательности нуклеотидов ДНК в последовательность нуклеотидов РНК.
А
Т
Г
Г
А
Ц
Г
А
Ц
Т
В определенном участке ДНК под действием ферментов белки-гистоны отделяются, водородные связи рвутся, и двойная спираль ДНК раскручивается. Одна из цепочек становится матрицей для построения и-РНК. Участок ДНК в определенном месте начинает раскручиваться под действием ферментов.
матрица
ДНК
Слайд 19
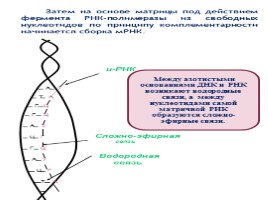
Затем на основе матрицы под действием фермента РНК-полимеразы из свободных нуклеотидов по принципу комплементарности начинается сборка мРНК.
А
Т
Г
Г
А
Ц
Г
А
Ц
Т
У
А
Ц
Ц
У
Г
Ц
У
Г
А
и-РНК
Водородная связь
Сложно-эфирная связь
Между азотистыми основаниями ДНК и РНК возникают водородные связи, а между нуклеотидами самой матричной РНК образуются сложно-эфирные связи.
А
Т
Г
Г
А
Ц
Г
А
Ц
Т
У
А
Ц
Ц
У
Г
Ц
У
Г
А
и-РНК
Водородная связь
Сложно-эфирная связь
Между азотистыми основаниями ДНК и РНК возникают водородные связи, а между нуклеотидами самой матричной РНК образуются сложно-эфирные связи.
Слайд 20

мРНК
После сборки мРНК водородные связи между азотистыми основаниями ДНК и мРНК рвутся, и новообразованная мРНК через поры в ядре уходит в цитоплазму, где прикрепляется к рибосомам. А две цепочки ДНК вновь соединяются, восстанавливая двойную спираль, и опять связываются с белками-гистонами. МРНК присоединяется к поверхности малой субъединицы в присутствии ионов магния. Причем два ее триплета нуклеотидов оказываются обращенными к большой субъединице рибосомы.
ЯДРО
рибосомы
цитоплазма
Mg2+
После сборки мРНК водородные связи между азотистыми основаниями ДНК и мРНК рвутся, и новообразованная мРНК через поры в ядре уходит в цитоплазму, где прикрепляется к рибосомам. А две цепочки ДНК вновь соединяются, восстанавливая двойную спираль, и опять связываются с белками-гистонами. МРНК присоединяется к поверхности малой субъединицы в присутствии ионов магния. Причем два ее триплета нуклеотидов оказываются обращенными к большой субъединице рибосомы.
ЯДРО
рибосомы
цитоплазма
Mg2+
Слайд 21

Трансляция
Второй этап биосинтеза– трансляция. Трансляция– это перевод последовательности нуклеотидов в последовательность аминокислот белка. В цитоплазме аминокислоты под строгим контролем ферментов аминоацил-тРНК-синтетаз соединяются с тРНК, образуя аминоацил-тРНК. Это очень видоспецифичные реакции: определенный фермент способен узнавать и связывать с соответствующей тРНК только свою аминокислоту.
и-РНК
А
Г
У
У
Ц
А
У
Ц
А
А
Г
У
а/к
а/к
а/к
У
У
Г
А
Ц
У
У
Г
Ц
Второй этап биосинтеза– трансляция. Трансляция– это перевод последовательности нуклеотидов в последовательность аминокислот белка. В цитоплазме аминокислоты под строгим контролем ферментов аминоацил-тРНК-синтетаз соединяются с тРНК, образуя аминоацил-тРНК. Это очень видоспецифичные реакции: определенный фермент способен узнавать и связывать с соответствующей тРНК только свою аминокислоту.
и-РНК
А
Г
У
У
Ц
А
У
Ц
А
А
Г
У
а/к
а/к
а/к
У
У
Г
А
Ц
У
У
Г
Ц
Слайд 22
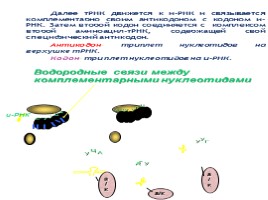
Далее тРНК движется к и-РНК и связывается комплементарно своим антикодоном с кодоном и-РНК. Затем второй кодон соединяется с комплексом второй аминоацил-тРНК, содержащей свой специфический антикодон.
Антикодон– триплет нуклеотидов на верхушке тРНК.
Кодон– триплет нуклеотидов на и-РНК.
и-РНК
А
Г
У
У
Ц
А
У
Ц
А
А
Г
У
а/к
а/к
а/к
У
У
Г
А
Ц
У
У
Г
Ц
Водородные связи между комплементарными нуклеотидами
и-РНК
А
Г
У
У
Ц
А
У
Ц
А
А
Г
У
а/к
а/к
а/к
У
У
Г
А
Ц
У
У
Г
Ц
Водородные связи между комплементарными нуклеотидами
Слайд 23
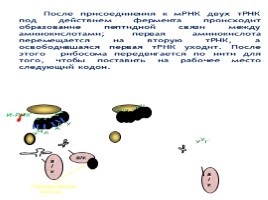
После присоединения к мРНК двух тРНК под действием фермента происходит образование пептидной связи между аминокислотами; первая аминокислота перемещается на вторую тРНК, а освободившаяся первая тРНК уходит. После этого рибосома передвигается по нити для того, чтобы поставить на рабочее место следующий кодон.
И-РНК
А
Г
У
У
Ц
А
У
Ц
А
А
Г
У
а/к
а/к
У
У
Г
А
Ц
У
У
Г
Ц
Пептидная связь
а/к
И-РНК
А
Г
У
У
Ц
А
У
Ц
А
А
Г
У
а/к
а/к
У
У
Г
А
Ц
У
У
Г
Ц
Пептидная связь
а/к
Слайд 24

Такое последовательное считывание рибосомой заключенного в и-РНК «текста» продолжается до тех пор, пока процесс не доходит до одного из стоп-кодонов (терминальных кодонов). Такими триплетами являются триплеты УАА, УАГ,УГА.
Одна молекула мРНК может заключать в себе инструкции для синтеза нескольких полипептидных нитей. Кроме того, большинство молекул и-РНК транслируется в белок много раз, так как к одной молекуле и-РНК прикрепляется обычно много рибосом.
и-РНК на рибосомах
белок
Наконец, ферменты разрушают эту молекулу и-РНК, расщепляя ее до отдельных нуклеотидов.
и-РНК на рибосомах
белок
Наконец, ферменты разрушают эту молекулу и-РНК, расщепляя ее до отдельных нуклеотидов.
Слайд 25

Понимание механизма синтеза белка—результат длительной и сложнейшей работы многих ученых. Это блестящее достижение сейчас является одним из основных положений биологической науки. Но все же еще многое из этого процесса осталось за гранью нашего знания.
Слайд 26

СПАСИБО ЗА ВНИМАНИЕ.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.