Презентация - Металдарға жалпы сипаттама
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 91%
- Слайдов: 18
- Просмотров: 3152
- Скачиваний: 370
- Размер: 5.35 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Металдарға жалпы сипаттама
Teacher: Zholtay Gulnaz
Слайд 2

Metals — электр тоғы мен жылуды жақсы өтк зет н, пластикалық қасиет жоғары, жылтыр matters. Мұндай properties-д ң болуы металдардың шк құрылымымен байланысты.
Металдардың (сынаптан басқа) crystal cell көздерінде металл атомдары орналасқан. Олар бір-бірімен metallic bond-пен байланысады. Металдардың иондану энергиясы аз болғандықтан олардың валенттік электрондары оңай бөлініп, бүкіл кристалдың бойында еркін қозғала алады. Сондықтан олардың жиынтығын gas of electron деп те атайды. In aqueous solutions reactions үшін металдың активтілігі оның активті қатардағы орнына байланысты.
Слайд 3

МЕТАЛДАРДЫҢ ПЕРИОДТЫҚ ЖҮЙЕДЕГІ ОРЫНЫ
Non-metals пен металдардың периодтық кестедегі орнын «Boron– silicon– arsenic – tellurium – astat» элементтерінен тұратын диагональ шектейді. Осы диагональдан сол жағынан төмен орындардағы барлық элементтер металдарға жатады.
Слайд 4

1 2 3 4
МЕТАЛДАРҒА ЖАТАТЫНДАР:
Барлық S- элементтер ( Н,Не басқа)
Барлық d- және f- элементтер
ІІІ топтың бордан басқа р- элементтері
IV және V топтың, VI және VII- периодтың р- элементтері (Sn,Pb, Sb, Bi, Po, At сыртқы қабаттарында 4-5 electrons бар)
Слайд 5

1.S –элементтерінің valence электрондарының жалпы formula ns 1;2 ( n= 1-7) ns 1 - сілтілікметалдар (Li, Na, K, Rb, Cs, Fr ) ns 2 - сілтілікжер металдар (Mg, Ca, Sr, Ba, Ra )
МЕТАЛДАРДЫҢ АТОМ ҚҰРЫЛЫСЫНДАҒЫ ЕРЕКШЕЛІКТЕР:
2. р-элементтерінің валенттілік электрондарының жалпы формуласы ns2 nр1-6 (n≥ 2, олардың ішінде металдарға жататын элементтер үшін n=5-6)
3. d- элементтерінің валенттілік электрондарының жалпы формуласы ns 2 (n-1) d 1-10 (n≥ 4, үлкен периодтардың қосымша топшаларының элементтері, олардың сыртқы қабаттарында бір немесе екі электрон болады
Слайд 6

Қосымша топша металдары үшін, негізгі топшадағы заңдылықтар сақталады. Бірақ V және VI- периодтың металдары үшін кезекті электрондарының ішкі energy level-ге орналасуына байланысты atomic radius өзгермейді немесе аздап артуы мүмкін.
Металл атомдарының қасиеттер н сипаттайтын шамалар :
Негізгі топшадағы металдардың атом радиустары жоғарыдан төмен қарай артады, ionization energies-нің шамасы мен электрон тартқыштық және electronegativity қасиеттері кемиді.Олай болса металдық қасиет топ бойынша біртіндеп артады.
Период бойынша металл атомдарының радиусы біртіндеп кемиді, сондықтан иондану энергиясы, электронтартқыштық және электртерістілік қасиеттері артады. Сәйкесінше металдық қасиет период бойынша біртіндеп азаяды.
Слайд 7

Табиғатта кездесу не қарай металдарды б рнеше топқа бөлуге болады:
Сиректеу кездесетін металдар:Sc,V,La, лантаноидтар
Сирек кездесетін металдар:Li,Be,Cs,Rb
1.Асыл металдар:Au, Ag, Pt, Rh,Ir, Oc, Ru
1.Шашыранды металдар:Ga, In, Ge,Te
Радиактивті металдар:U, Th,Ac, актиноидтар
Слайд 8

Табиғатта көп кездесет н металдар
Al (8,1%) Fe (4,65%) Ca (3,6%) Na (2,64%) K (2,5%) Mg (2,1%) Tі (0,57%) Mn (0,1%) Ba (0,05%) Sr (0,03%) Қалғандары (0,1365%)
Көптеген металдар табиғатта тек қосылыстар түрінде кездеседі. Табиғи қосылыстардың табиғаты металдың белсенділігіне байланысты. Металл неғұрлым белсенді болса, олардың табиғи қосылыстары – тұздар.Мысалы: alkali metals – halides, nitrates, sulfates түрінде кездеседі. Бұл қосылыстардың барлығы суда жақсы ериді.(NaCI- ас тұзы, KCI·NaCI-сильвинит). Белсенділігі біраз төмен сілтілік жер металдар суда нашар еритін сульфаттар, carbonates түрінде кездеседі( CaCO3- мәрмәр, CaSO4· 2H2O- ғаныш, CaCO3 ·MgCO3 - доломит) . Алюминий кешенді қосылыс түзе алу мүмкіндігіне байланысты алюмосиликаттар және кешенді қосылыс түрінде кездеседі. ( AI2O3 2SiO2 2H2O- коаллин, боксит AI2O3 ·2SiO2 ·2H2O, креолит Na3 [AIF6]
Al (8,1%) Fe (4,65%) Ca (3,6%) Na (2,64%) K (2,5%) Mg (2,1%) Tі (0,57%) Mn (0,1%) Ba (0,05%) Sr (0,03%) Қалғандары (0,1365%)
Көптеген металдар табиғатта тек қосылыстар түрінде кездеседі. Табиғи қосылыстардың табиғаты металдың белсенділігіне байланысты. Металл неғұрлым белсенді болса, олардың табиғи қосылыстары – тұздар.Мысалы: alkali metals – halides, nitrates, sulfates түрінде кездеседі. Бұл қосылыстардың барлығы суда жақсы ериді.(NaCI- ас тұзы, KCI·NaCI-сильвинит). Белсенділігі біраз төмен сілтілік жер металдар суда нашар еритін сульфаттар, carbonates түрінде кездеседі( CaCO3- мәрмәр, CaSO4· 2H2O- ғаныш, CaCO3 ·MgCO3 - доломит) . Алюминий кешенді қосылыс түзе алу мүмкіндігіне байланысты алюмосиликаттар және кешенді қосылыс түрінде кездеседі. ( AI2O3 2SiO2 2H2O- коаллин, боксит AI2O3 ·2SiO2 ·2H2O, креолит Na3 [AIF6]
Слайд 9

Металдардың физикалық қасиеттер
Металл кристалындағы атомдар, иондар "электрон газымен" берік ұсталып, металдық байланыс түзеді. Кристалдағы бос электрондарға тəуелді металдар белгілі бір ортақ қасиеттерге ие болады. Бұл қасиеттерге жылу жəне электрөткізгіштік, металдық жылтыры, иілімділігі, т.б қасиеттері жатады.
Электр жəне жылуөткізгіштігі
Металдық жылтыры
Иілімділігі (пластикалығы)
Бұл металдардың өзіне тəн қасиеттерінің бірі-оны адамдар өте жоғары бағалап, кейбір көркемөнер туындыларын жасауға пайдаланады. Металдың бəрі де мөлдір емес, өзіндік жылтыры бар. Олар көбінесе сұр түсті болып келеді.
Электр өрісінің əсерінен электрондар бағытты қозғалысқа ие болады, сөйтіп, электр тогы пайда болады. Электрөткізгіштігі ең жоғары металдар күміс пен мыс, одан кейін алтын, алюминий, темір болып келеді. Ең аз электрөткізгіштік сынапқа тəн.
Металдарды соққанда, ұсақ түйіршіктерге бөлініп шашырап қалмайды, небəрі пішінін өзгертіп тапталады не жанашылады, яғни соғуға төзімді пластикалық қасиетін, иілімділігін көрсетеді.
Металл кристалындағы атомдар, иондар "электрон газымен" берік ұсталып, металдық байланыс түзеді. Кристалдағы бос электрондарға тəуелді металдар белгілі бір ортақ қасиеттерге ие болады. Бұл қасиеттерге жылу жəне электрөткізгіштік, металдық жылтыры, иілімділігі, т.б қасиеттері жатады.
Электр жəне жылуөткізгіштігі
Металдық жылтыры
Иілімділігі (пластикалығы)
Бұл металдардың өзіне тəн қасиеттерінің бірі-оны адамдар өте жоғары бағалап, кейбір көркемөнер туындыларын жасауға пайдаланады. Металдың бəрі де мөлдір емес, өзіндік жылтыры бар. Олар көбінесе сұр түсті болып келеді.
Электр өрісінің əсерінен электрондар бағытты қозғалысқа ие болады, сөйтіп, электр тогы пайда болады. Электрөткізгіштігі ең жоғары металдар күміс пен мыс, одан кейін алтын, алюминий, темір болып келеді. Ең аз электрөткізгіштік сынапқа тəн.
Металдарды соққанда, ұсақ түйіршіктерге бөлініп шашырап қалмайды, небəрі пішінін өзгертіп тапталады не жанашылады, яғни соғуға төзімді пластикалық қасиетін, иілімділігін көрсетеді.
Слайд 10

ТЫҒЫЗДЫҒЫ БОЙЫНША МЕТАЛДАР:
Жеңіл металдар, ρ<5г/см 3, ең жеңіл металл – Литий, ρ(Li) = 0,53г/см 3.
Ауыр металдар, ρ>5г/см 3, ең ауыр металл – Осмий, ρ(Os) = 5,9г/см 3.
Жеңіл металдар, ρ<5г/см 3, ең жеңіл металл – Литий, ρ(Li) = 0,53г/см 3.
Ауыр металдар, ρ>5г/см 3, ең ауыр металл – Осмий, ρ(Os) = 5,9г/см 3.
Слайд 11

БАЛҚУ ТЕМПЕРАТУРАСЫНА ҚАРАЙ:
1.Оңай балқитын металдар, tб<1000 0С; ең оңай балқитын металл-сынап, tб(Hg)=-38,90С;
2. Қиын балқитын металдар, tб>1000 0С; ең қиын балқитын металл–вольфрам, tб(W)=33900С;
Слайд 12

Қаттылығы алмаздың қаттылығынан (10) төмен металдар жұмсақ металдар д.а., ең жұмсақ металдар - с лт л кметалдар, оның ш нде калий-К, пышақпен оңай кесуге болады.
Item 1 100%
Қаттылығына байланысты:
Қаттылығы алмаздың қаттылығынан (10) жоғары Item 1 50% металдар қатты металдар д.а., ең қатты металдар – вольфрам, хром; хром – ең қатты металл, ол шыныны кесед .
50%
Слайд 13

Қара металдар-тем р және оның құймалары: шойын, болат, ферроқорытпалар, шартты түрде бұл топқа марганец пен хром к ред .
Түст металдар (тем рденбасқа металдар): Мысалы: мыс, күм с, алтын, платина т.б
Слайд 14

МЕТАЛДАРДЫҢ ХИМИЯЛЫҚ ҚАСИЕТТЕРІ
Металдардың атом радиусының үлкен және иондану энергиясы кіші болуына байланысты олар электрондарын оңай береді, сондықтан тотықсыздандырғыштар болады, қосылыстарындағы тотығу дәрежелері оң мәнді болып келеді.
Слайд 15

Металдардың электрондарын беру қабілеті әртүрлі болады, осыған байланысты металдардың активті қатары құрылған, оны ұсынған Н.Н.Бекетов (1865ж).
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Au
Слайд 16
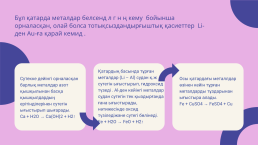
Бұл қатарда металдар белсенд л г н ң кему бойынша орналасқан, олай болса тотықсыздандырғыштық қасиеттер Li-ден Au-ға қарай кемид .
Қатардың басында тұрған металдар (Li – Al) судан қ.ж сутегін ығыстырып, гидроксид түзеді . Al-ден кейінгі металдар судан сутегін тек қыздырғанда ғана ығыстырады, нәтижесінде оксид түзіледіжәне сутегі бөлінеді. Fe + Н2О → FeО + Н2↑
Сутекке дейінгі орналасқан барлық металдар азот қышқылынан басқа қышқылдардың ерітінділерінен сутегін ығыстырып шығарады. Са + Н2О → Са(ОН)2 + Н2↑
Осы қатардағы металлдар өзінен кейін тұрған металдарды тұздарынан ығыстыра алады. Fe + CuSО4 → FeSО4 + Cu
Слайд 17

Өзіндік жұмыс
Өзіндік жұмысты орындауға 15 минут беріледі. Берілген сілтемеге кіріп тапсырмаларды орында.
Сілтеме: https://testmoz.com/q/11538210
Слайд 18

Үй тапсырмасы:
Сөздіктерді жаттау. Берілген сөздердің ағылшын тіліндегі аудармасын табу. Қатемен жұмыс жасау.
·Тотықсыздандырғыш ·Тотықтырғыш ·Алюминий ·Калий ·Қосылыстар ·Балқу температурасы ·Химиялық қасиеттер ·Физикалық қасиеттер ·Тығыздық ·Металдардың активті қатары
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







