Слайды и текст этой онлайн презентации
Слайд 1
Учитель физики
ОГКОУ КШИ
“Колпашевский кадетский корпус”
Семин А.А.
Первый закон термодинамики
Слайд 2
Изучить закон сохранения энергии, распространённый на тепловые явления – первый закон термодинамики.
Рассмотреть изопроцессы в газах с энергетической точки зрения, примененив к ним первый закон термодинамики.
Дать понятие адиабатического процесса.
Цели
Слайд 3
Фронтальный опрос
1. Дать определение внутренней энергии.
2.Что называют количеством теплоты?
Повторение
3 .Что называют вечным двигателем первого рода ?
Слайд 4
Содержание 1-ого закона термодинамики
Применение 1-ого закона термодинамики к изопроцессам в газах
Адиабатический процесс
Необратимость процессов в природе
План урока
Слайд 5
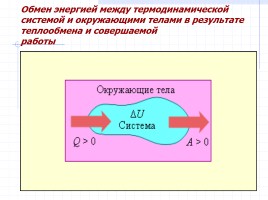
Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой
работы
Слайд 6
Изменение Δ U внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы A внешних сил и количества теплоты Q, переданного системе
Первый закон термодинамики
ΔU = Q + A
Слайд 7
Q = ΔU + A’
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Вторая запись
первого закона термодинамики
Слайд 8
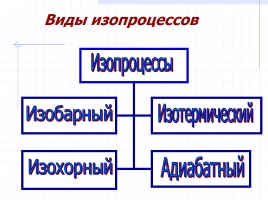
Виды изопроцессов
Изопроцессы
Изобарный
Изохорный
Изотермический
Адиабатный
Слайд 9
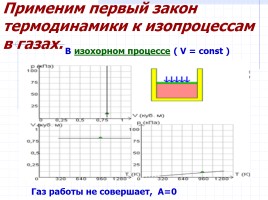
Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе ( V = const )
Газ работы не совершает, А=0
Слайд 10
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях.
Q = ΔU = U (T2) – U (T1)
Первый закон термодинамики для изохорного процесса
Слайд 11
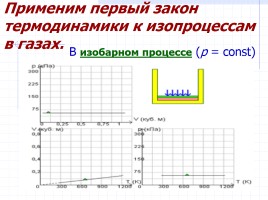
Применим первый закон термодинамики к изопроцессам в газах.
В изобарном процессе (p = const)
Слайд 12
Работа, совершаемая газом, выражается соотношением
A = p (V2 – V1) = p ΔV
p-давление
V1,V2- объем в начальном и конечном состояниях соответственно
Слайд 13
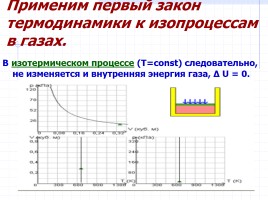
Применим первый закон термодинамики к изопроцессам в газах.
Первый закон термодинамики для изобарного процесса :
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV
Слайд 14
Применим первый закон термодинамики к изопроцессам в газах.
В изотермическом процессе (T=const) следовательно, не изменяется и внутренняя энергия газа, Δ U = 0.
Слайд 15
Первый закон термодинамики для изотермического процесса выражается соотношением
Q = A
Количество теплоты Q, полученной газом в процессе изотермического расширения,
превращается в работу над внешними телами.
Слайд 16
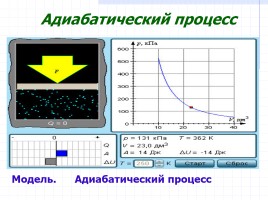
Адиабатический процесс
Модель. Адиабатический процесс
Слайд 17
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид
газ совершает работу за счет убыли его внутренней энергии.
A = –ΔU
Слайд 18
Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа
(A > 0) (Δ U < 0)
Слайд 19
Работа газа в адиабатическом процессе просто выражается через температуры T 1 и T 2 начального и конечного состояний
A = CV (T2 – T1)
Слайд 20
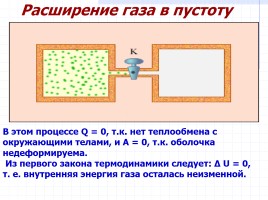
Расширение газа в пустоту
В этом процессе Q = 0, т.к. нет теплообмена с окружающими телами, и A = 0, т.к. оболочка недеформируема.
Из первого закона термодинамики следует: Δ U = 0, т. е. внутренняя энергия газа осталась неизменной.
Слайд 21
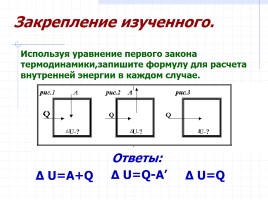
Δ U=A+Q
Δ U=Q
Δ U=Q-A’
Используя уравнение первого закона термодинамики,запишите формулу для расчета внутренней энергии в каждом случае.
Закрепление изученного.
Ответы:
Слайд 22
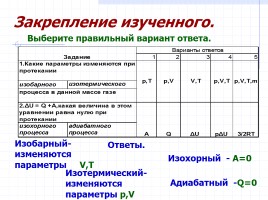
Ответы.
Изобарный- изменяются
параметры V,T
Изотермический-изменяются
параметры p,V
Изохорный - A=0
Адиабатный -Q=0
Выберите правильный вариант ответа.
Закрепление изученного.
Слайд 23
Список использованных источников
1. Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский «ФИЗИКА 10», Москва, « Просвещение» , 2010 г.
 Решение задач на законы термодинамики
Решение задач на законы термодинамики Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика Импульс тела (примеры на закон сохранения импульса)
Импульс тела (примеры на закон сохранения импульса) Закономерности и случайности в жизни народов
Закономерности и случайности в жизни народов Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы Импульс. Закон сохранения импульса
Импульс. Закон сохранения импульса Механическая энергия. Закон сохранения энергии
Механическая энергия. Закон сохранения энергии