Слайды и текст этой онлайн презентации
Слайд 1
Строение электронных оболочек атомов
8 класс
Слайд 2
Сначала заполняется электронами ближайший к ядру слой. На этом слое не больше 2-х электронов
Слайд 3
Электронная оболочка – это совокупность всех электронов в атоме, окружающих ядро
Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки
По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее
Слайд 4
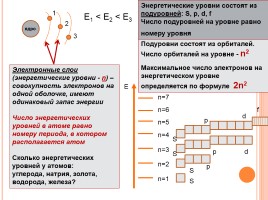
Подуровни состоят из орбиталей. Число орбиталей на уровне - n2
Максимальное число электронов на энергетическом уровне определяется по формуле 2n2
1
2
3
Е1 < E2 < E3
Электронные слои (энергетические уровни - n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Энергетические уровни состоят из подуровней: S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
Слайд 5
Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
Слайд 6
ЗАПОМНИТЕ!
Электроны, расположенные на последней электронной оболочке, называются внешними.
Число внешних электронов для химических элементов главных подгрупп равно номеру группы, в которой находится элемент
Слайд 7
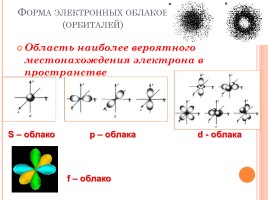
Форма электронных облаков (орбиталей)
Область наиболее вероятного местонахождения электрона в пространстве
S – облако р – облака d - облака
f – облако
Слайд 8
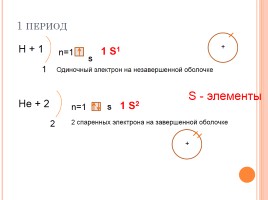
1 период
Н + 1
1
n=1
S
1 S1
Нe + 2
2
n=1
S
1 S2
Одиночный электрон на незавершенной оболочке
2 спаренных электрона на завершенной оболочке
S - элементы
+
+
Слайд 9
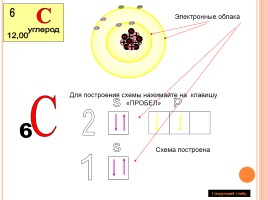
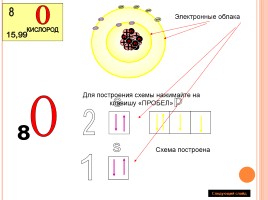
Электронные облака
С
6
Схема построена
Для построения схемы нажимайте на клавишу «ПРОБЕЛ»
Следующий слайд
Слайд 10
Электронные облака
O
8
Схема построена
Для построения схемы нажимайте на клавишу «ПРОБЕЛ»
Следующий слайд
Слайд 11
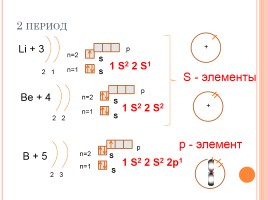
2 период
Li + 3
2 1
n=1
n=2
1 S2 2 S1
Be + 4
2 2
n=1
n=2
1 S2 2 S2
B + 5
2 3
n=1
n=2
1 S2 2 S2 2p1
S - элементы
р - элемент
S
S
S
S
S
S
p
p
p
+
+
+
+
Слайд 12
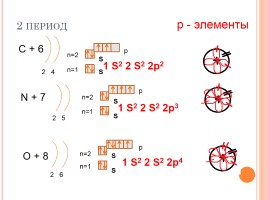
2 период
С + 6
2 4
n=1
n=2
N + 7
2 5
n=1
n=2
O + 8
2 6
n=1
n=2
1 S2 2 S2 2p4
р - элементы
1 S2 2 S2 2p2
1 S2 2 S2 2p3
S
S
S
S
S
S
p
p
p
Слайд 13
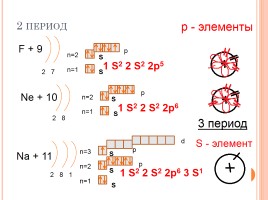
2 период
F + 9
2 7
n=1
n=2
Ne + 10
2 8
n=1
n=2
Na + 11
2 8 1
n=1
n=2
1 S2 2 S2 2p6 3 S1
р - элементы
1 S2 2 S2 2p5
1 S2 2 S2 2p6
3 период
S - элемент
S
S
S
S
S
S
S
p
p
p
p
d
n=3
Слайд 14
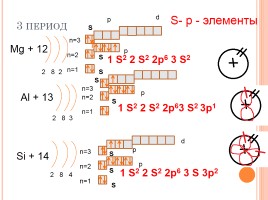
3 период
Mg + 12
2 8 2
n=1
n=2
Al + 13
2 8 3
n=1
n=2
Si + 14
2 8 4
n=1
n=2
1 S2 2 S2 2p6 3 S 3p2
S- р - элементы
1 S2 2 S2 2p6 3 S2
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p1
Слайд 15
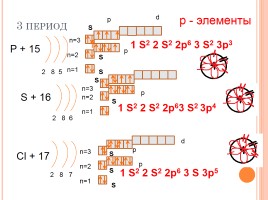
3 период
P + 15
2 8 5
n=1
n=2
S + 16
2 8 6
n=1
n=2
Cl + 17
2 8 7
n=1
n=2
1 S2 2 S2 2p6 3 S 3p5
р - элементы
1 S2 2 S2 2p6 3 S2 3p3
1 S2 2 S2 2p63 S2
S
S
S
S
S
S
S
p
p
p
p
d
n=3
n=3
S
p
d
n=3
3p4
Слайд 16
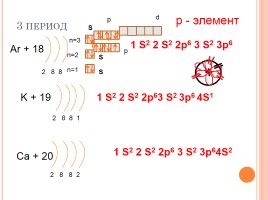
3 период
Ar + 18
2 8 8
n=1
n=2
K + 19
2 8 8 1
Ca + 20
2 8 8 2
1 S2 2 S2 2p6 3 S2 3p64S2
р - элемент
1 S2 2 S2 2p6 3 S2 3p6
1 S2 2 S2 2p63 S2
S
S
p
n=3
S
p
d
3p6 4S1
Слайд 17
ВЫВОДЫ
Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов
Одинаковое строение внешних энергетических уровней периодически (т.е. через определенные промежутки - периоды) повторяется, поэтому периодически повторяются и свойства химических элементов
 Строение электронных оболочек атомов
Строение электронных оболочек атомов Электронное строение атомов
Электронное строение атомов Построение графиков функции с помощью электронной таблицы Excel
Построение графиков функции с помощью электронной таблицы Excel Формулы с встроенными функциями в электронной таблице (9 класс)
Формулы с встроенными функциями в электронной таблице (9 класс)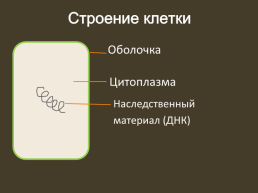 Строение клетки. Оболочка. Цитоплазма
Строение клетки. Оболочка. Цитоплазма Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов
Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов Электронная физкультминутка для глаз
Электронная физкультминутка для глаз