Презентация - Простые вещества - металлы
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 87%
- Слайдов: 22
- Просмотров: 5239
- Скачиваний: 998
- Размер: 3.93 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Простые вещества - неметаллы
Простые вещества - неметаллы Правила обращения с веществами и лабораторным оборудованием
Правила обращения с веществами и лабораторным оборудованием Соляная гора в Германии - Природные соединения щелочных металлов
Соляная гора в Германии - Природные соединения щелочных металлов Простые механизмы. Рычаг. Условие равновесия рычага
Простые механизмы. Рычаг. Условие равновесия рычага Окружающий мир 3 класс «Из чего состоит вещество?»
Окружающий мир 3 класс «Из чего состоит вещество?» Металлы
Металлы Неметаллы. Бор. Графит
Неметаллы. Бор. Графит
Слайды и текст этой онлайн презентации
Слайд 1

Простые вещества - металлы
Слайд 2

Какой металл самый – самый…
Самый легкий металл – Самый тяжелый металл – Самый легкоплавкий металл – Самый тугоплавкий металл – Самый мягкий металл - Самый твердый металл – Самый электропроводный металл – Самый блестящий металл – Самый пластичный металл – Самый звонкий металл –
Самый легкий металл – Самый тяжелый металл – Самый легкоплавкий металл – Самый тугоплавкий металл – Самый мягкий металл - Самый твердый металл – Самый электропроводный металл – Самый блестящий металл – Самый пластичный металл – Самый звонкий металл –
Слайд 3

Какой металл самый – самый…
Самый легкий металл – литий Самый тяжелый металл – осмий Самый легкоплавкий металл – ртуть Самый тугоплавкий металл – вольфрам Самый мягкий металл - цезий Самый твердый металл – хром Самый электропроводный металл – серебро Самый блестящий металл – серебро Самый пластичный металл – золото Самый звонкий металл – золото.
Самый легкий металл – литий Самый тяжелый металл – осмий Самый легкоплавкий металл – ртуть Самый тугоплавкий металл – вольфрам Самый мягкий металл - цезий Самый твердый металл – хром Самый электропроводный металл – серебро Самый блестящий металл – серебро Самый пластичный металл – золото Самый звонкий металл – золото.
Слайд 4

Верю – не верю
А) Литий, натрий, калий, медь являются щелочными металлами. Б) Металлы пропускают световые лучи. В) Большинство металлов в равной степени рассеивают все лучи видимой части спектра. Г) Ртуть – легкий металл, поэтому используется в физических приборах. Д) Общие физические свойства металлов обусловлены положением металлов в ПСХЭ.
А) Литий, натрий, калий, медь являются щелочными металлами. Б) Металлы пропускают световые лучи. В) Большинство металлов в равной степени рассеивают все лучи видимой части спектра. Г) Ртуть – легкий металл, поэтому используется в физических приборах. Д) Общие физические свойства металлов обусловлены положением металлов в ПСХЭ.
Слайд 5

Химические свойства металлов
Цель урока: обобщить и закрепить знания о химических свойствах металлов, уметь составлять уравнения химических реакций на основании положения металла в электрохимическом ряду напряжений. Истинный химик должен быть теоретиком и практиком. (М.В.Ломоносов)
Цель урока: обобщить и закрепить знания о химических свойствах металлов, уметь составлять уравнения химических реакций на основании положения металла в электрохимическом ряду напряжений. Истинный химик должен быть теоретиком и практиком. (М.В.Ломоносов)
Слайд 6

Вопросы на размышление
Какую роль выполняют металлы в химических реакциях? Как оценить активность металлов в реакциях с их участием? Какую информацию о свойствах металлов можно получить на основании их положения в электрохимическом ряду напряжений металлов?
Какую роль выполняют металлы в химических реакциях? Как оценить активность металлов в реакциях с их участием? Какую информацию о свойствах металлов можно получить на основании их положения в электрохимическом ряду напряжений металлов?
Слайд 7

Кратко из биографии
Николай Николаевич Бекетов (1827–1911) – русский ученый, основатель отечественной школы физической химии, академик Петербургской академии наук с 1886г. Родился 1 (13) января 1827 года в селе Новая Бекетовка Пензенской губернии. В 1844 году поступил в Петербургский университет, а на третьем курсе перешел в Казанский университет. В 1847–1853 годах работал в Петербурге в Медико-химической лаборатории под руководством знаменитого химика Н.Н. Зинина. В 1855 году стал профессором Харьковского университета, читал лекции по физической химии и руководил проводившимися в университете практическими исследованиями. В 1864 году по его предложению в Харьковском университете открылось первое в России физико-химическое отделение. Бекетов открыл способ восстановления металлов из их оксидов, составил вытеснительный ряд металлов, который был назван его именем.
Николай Николаевич Бекетов (1827–1911) – русский ученый, основатель отечественной школы физической химии, академик Петербургской академии наук с 1886г. Родился 1 (13) января 1827 года в селе Новая Бекетовка Пензенской губернии. В 1844 году поступил в Петербургский университет, а на третьем курсе перешел в Казанский университет. В 1847–1853 годах работал в Петербурге в Медико-химической лаборатории под руководством знаменитого химика Н.Н. Зинина. В 1855 году стал профессором Харьковского университета, читал лекции по физической химии и руководил проводившимися в университете практическими исследованиями. В 1864 году по его предложению в Харьковском университете открылось первое в России физико-химическое отделение. Бекетов открыл способ восстановления металлов из их оксидов, составил вытеснительный ряд металлов, который был назван его именем.
Слайд 8

Ряд напряжений металлов
Металлы расположены в порядке убывания восстановительных свойств при реакциях в водных растворах в стандартных условиях; Металлы, стоящие левее, вытесняют металлы, стоящие правее, из их солей в растворе; Металлы, стоящие в этом ряду до водорода, вытесняют его из кислот в растворе (кроме HNO3 и концентрированной H2SO4 ) Ме до Al + H2O == щелочь + H2 Ме после Al + H2O =t= оксид + H2 Ме после H + H2O =/=
Металлы расположены в порядке убывания восстановительных свойств при реакциях в водных растворах в стандартных условиях; Металлы, стоящие левее, вытесняют металлы, стоящие правее, из их солей в растворе; Металлы, стоящие в этом ряду до водорода, вытесняют его из кислот в растворе (кроме HNO3 и концентрированной H2SO4 ) Ме до Al + H2O == щелочь + H2 Ме после Al + H2O =t= оксид + H2 Ме после H + H2O =/=
Слайд 9

Взаимодействуют с кислородом
Na + О2 = Li + О2 = Cu + О2 = Ag + О2 =
Na + О2 = Li + О2 = Cu + О2 = Ag + О2 =
Слайд 10

Взаимодействуют с кислородом
2Na + О2 = Na2О2 4Li + О2 = 2Li2 О 2Cu + О2 = 2Cu О Ag + О2 =/=
2Na + О2 = Na2О2 4Li + О2 = 2Li2 О 2Cu + О2 = 2Cu О Ag + О2 =/=
Слайд 11

Взаимодействуют с неметаллами
Fe + Br2 = Al + S = Li + N2 = Na + H2 =
Fe + Br2 = Al + S = Li + N2 = Na + H2 =
Слайд 12

Взаимодействуют с неметаллами
2Fe + 3Br2 =t= 2FeBr3 2Al + 3S =t= Al2S3 6Li + N2 = 2Li3N 2Na + H2 =t= 2NaH
2Fe + 3Br2 =t= 2FeBr3 2Al + 3S =t= Al2S3 6Li + N2 = 2Li3N 2Na + H2 =t= 2NaH
Слайд 13
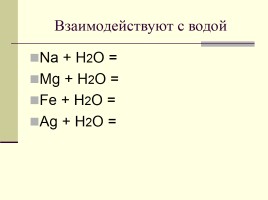
Взаимодействуют с водой
Na + H2O = Mg + H2O = Fe + H2O = Ag + H2О =
Na + H2O = Mg + H2O = Fe + H2O = Ag + H2О =
Слайд 14

Взаимодействуют с водой
2Na + 2H2O = 2NaОН + H2 Mg + 2H2O =t= Mg(ОН)2 +H2 3Fe + 4H2O =t= Fe3O4 + 4H2 Ag + H2О =/=
2Na + 2H2O = 2NaОН + H2 Mg + 2H2O =t= Mg(ОН)2 +H2 3Fe + 4H2O =t= Fe3O4 + 4H2 Ag + H2О =/=
Слайд 15
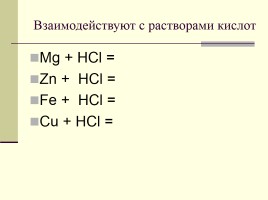
Взаимодействуют с растворами кислот
Mg + HCl = Zn + HCl = Fe + HCl = Cu + HCl =
Mg + HCl = Zn + HCl = Fe + HCl = Cu + HCl =
Слайд 16

Взаимодействуют с растворами кислот
Mg + 2HCl = MgCl2 + H2 Zn + 2HCl = ZnCl2 + H2 Fe + 2HCl = FeCl2 + H2 Cu + HCl =/=
Mg + 2HCl = MgCl2 + H2 Zn + 2HCl = ZnCl2 + H2 Fe + 2HCl = FeCl2 + H2 Cu + HCl =/=
Слайд 17

Взаимодействуют с растворами солей
Fe + CuSO4 = Cu + FeSO4 =
Fe + CuSO4 = Cu + FeSO4 =
Слайд 18

Взаимодействуют с растворами солей
Fe + CuSO4 = FeSO4 + Cu Cu + FeSO4 =/=
Fe + CuSO4 = FeSO4 + Cu Cu + FeSO4 =/=
Слайд 19

Взаимодействуют с органическими веществами
А) реакция с одноатомными спиртами, многотомными спиртами, фенолом: СН2 - ОН СН2 - ОNa | +2Na = | + H2 СН2 - ОН СН2 - ОNa Б) реакция Вюрца: СН3 - Cl+ 2Na = СН3 - СН3 + 2NaCl В) образование ацетиленидов СH ≡ СН + 2Na =NH3= СNa ≡ СNa + H2 Г) образование металлоорганических соединений СН3 – Cl + Mg = СН3MgCl
А) реакция с одноатомными спиртами, многотомными спиртами, фенолом: СН2 - ОН СН2 - ОNa | +2Na = | + H2 СН2 - ОН СН2 - ОNa Б) реакция Вюрца: СН3 - Cl+ 2Na = СН3 - СН3 + 2NaCl В) образование ацетиленидов СH ≡ СН + 2Na =NH3= СNa ≡ СNa + H2 Г) образование металлоорганических соединений СН3 – Cl + Mg = СН3MgCl
Слайд 20

Домашнее задание
§ 18 , страница 201 -207 упр. 6, 9, 13
§ 18 , страница 201 -207 упр. 6, 9, 13
Слайд 21

Закрепление
1. Кому не жаль «денег»? Однажды два приятеля – Алюминий и Калий – поздно возвращались домой. И вдруг на них неожиданно напал грабитель Хлор, который потребовал выложить кошельки с электронами. Как вы считаете, какой из приятелей легче расстанется со своим кошельком? Объясните, почему? 2.Нигде нет покоя… Когда Магний пришел в бар, там уже сидели: Кислород, Сера, Хлорид Натрия в растворе, разбавленная Серная Кислота и Гидроксид Меди (II). Присутствие каких веществ испортило ему настроение? Почему? Подтвердите свой ответ уравнениями реакций. 3. Задача. Некий жилец второго подъезда пришел в гости в квартиру №8 поиграть в шахматы. Кто из них кому пешку не уступил или шах поставил – неизвестно. Но только они крупно повзаимодействовали, в результате чего жилец массой 0,8г исчез, а вместо него образовалось 1,12г его оксида. Определите, как звали пропавшего жильца, который любил ходить в гости?
1. Кому не жаль «денег»? Однажды два приятеля – Алюминий и Калий – поздно возвращались домой. И вдруг на них неожиданно напал грабитель Хлор, который потребовал выложить кошельки с электронами. Как вы считаете, какой из приятелей легче расстанется со своим кошельком? Объясните, почему? 2.Нигде нет покоя… Когда Магний пришел в бар, там уже сидели: Кислород, Сера, Хлорид Натрия в растворе, разбавленная Серная Кислота и Гидроксид Меди (II). Присутствие каких веществ испортило ему настроение? Почему? Подтвердите свой ответ уравнениями реакций. 3. Задача. Некий жилец второго подъезда пришел в гости в квартиру №8 поиграть в шахматы. Кто из них кому пешку не уступил или шах поставил – неизвестно. Но только они крупно повзаимодействовали, в результате чего жилец массой 0,8г исчез, а вместо него образовалось 1,12г его оксида. Определите, как звали пропавшего жильца, который любил ходить в гости?
Слайд 22

спасибо за внимание
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
