Презентация - Неметаллы. Бор. Графит
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 87%
- Слайдов: 24
- Просмотров: 3325
- Скачиваний: 1346
- Размер: 6.01 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Сборник упражнений и заданий для решения орфографических задач
Сборник упражнений и заданий для решения орфографических задач Биография Бориса Пастернака
Биография Бориса Пастернака Выбор профессии на уроках географии
Выбор профессии на уроках географии Биография Бориса Константиновича Зайцева
Биография Бориса Константиновича Зайцева Разбор слова по составу
Разбор слова по составу Защитные сооружения гражданской обороны
Защитные сооружения гражданской обороны Сборник дидактических игр для устного счёта 1 класс (сложение и вычитание в пределах первого десятка)
Сборник дидактических игр для устного счёта 1 класс (сложение и вычитание в пределах первого десятка)
Слайды и текст этой онлайн презентации
Слайд 1

неметаллы
бор
графит
Слайд 2

неметаллы
НЕМЕТАЛЛЫ - химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы - водород, азот, кислород, фтор, хлор и благородные газы; жидкость - бром; твердые тела - бор, углерод, кремний, фосфор, мышьяк, сера, селен, теллур, иод, астат. Атомы неметаллов ( по сравнению с атомами металлов) содержат большее число электронов на внешнем энергетическом уровне, по этому простые вещества - неметаллы обладают, как правило, окислительно - восстановительной деятельностью (кроме фтора и кислорода, которые являются окислителями
НЕМЕТАЛЛЫ - химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы - водород, азот, кислород, фтор, хлор и благородные газы; жидкость - бром; твердые тела - бор, углерод, кремний, фосфор, мышьяк, сера, селен, теллур, иод, астат. Атомы неметаллов ( по сравнению с атомами металлов) содержат большее число электронов на внешнем энергетическом уровне, по этому простые вещества - неметаллы обладают, как правило, окислительно - восстановительной деятельностью (кроме фтора и кислорода, которые являются окислителями
Слайд 3

Для неметаллов характерно явление аллотропии. многие из них существуют в виде аллотропных видоизменений, например - фосфор, углерод, кислород, сера и т.д.
Неметаллы имеют различные типы кристаллической решетки - атомную (бор, кремний, углерод в виде алмаза) и молекулярную (йод, белый фосфор, сера кристаллическая)
Физические свойства неметаллов зависят от типа решетки. Вещества с молекулярной решеткой - летучие, легкоплавкие, непрочные, с незначительной растворимостью в воде.
Слайд 4

Слайд 5

водород, азот.
ВОДОРОД (лат. Hydrogenium) - Н, химический элемент VII группы периодической системы, атомный номер 1, атомная масса 1,00794. В природе встречаются два стабильных изотопа (протий и дейтерий) и один радиоактивный (тритий). Молекула двухатомна (Н2). Газ без цвета и запаха; плотность 0,0899 г/л, tкип = 252,76 .С. Соединяется с многими элементами, с кислородом образует воду. Самый распространенный элемент космоса; составляет (в виде плазмы) более 70% массы Солнца и звезд, основная часть газов межзвездной среды и туманностей. На Земле входит в состав воды, живых организмов, каменного угля, нефти. Применяют в производстве аммиака, соляной кислоты, для гидрогенизации жиров и др., при сварке и резке металлов. Входит в состав синтез-газа. Перспективен как горючее АЗОТ (лат. Nitrogenium) - N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067. Название от греческой a - отрицательная приставка и zoe - жизнь (не поддерживает дыхания и горения). Свободный азот состоит из 2-атомных молекул (N2); газ без цвета и запаха; плотность 1,25 г/л, tпл - 210 .C, tкип - 195,8 .C. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09% объема), разделением которого получают промышленный азот (более 3/4 идет на синтез аммиака). Применяется как инертная среда для многих технологических процессов; жидкий азот - хладагентный азот - один из основных биогенных элементов, входящий в состав белков и нуклеиновых кислот.
н
N
ВОДОРОД (лат. Hydrogenium) - Н, химический элемент VII группы периодической системы, атомный номер 1, атомная масса 1,00794. В природе встречаются два стабильных изотопа (протий и дейтерий) и один радиоактивный (тритий). Молекула двухатомна (Н2). Газ без цвета и запаха; плотность 0,0899 г/л, tкип = 252,76 .С. Соединяется с многими элементами, с кислородом образует воду. Самый распространенный элемент космоса; составляет (в виде плазмы) более 70% массы Солнца и звезд, основная часть газов межзвездной среды и туманностей. На Земле входит в состав воды, живых организмов, каменного угля, нефти. Применяют в производстве аммиака, соляной кислоты, для гидрогенизации жиров и др., при сварке и резке металлов. Входит в состав синтез-газа. Перспективен как горючее АЗОТ (лат. Nitrogenium) - N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067. Название от греческой a - отрицательная приставка и zoe - жизнь (не поддерживает дыхания и горения). Свободный азот состоит из 2-атомных молекул (N2); газ без цвета и запаха; плотность 1,25 г/л, tпл - 210 .C, tкип - 195,8 .C. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09% объема), разделением которого получают промышленный азот (более 3/4 идет на синтез аммиака). Применяется как инертная среда для многих технологических процессов; жидкий азот - хладагентный азот - один из основных биогенных элементов, входящий в состав белков и нуклеиновых кислот.
н
N
Слайд 6

o
F
Кислород,фтор
КИСЛОРОД (лат. Oxygenium) - О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций - О2 ("обычный" кислород) и О3 (озон). О2 - газ без цвета и запаха, плотность 1,42897 г/л, tпл -218,6 .С, tкип -182,96 .С. Химически самый активный (после фтора) неметалл. С большинством других элементов (водородом, галогенами, серой, многими металлами и т. д.) взаимодействует непосредственно (окисление) и, как правило, с выделением энергии. При повышении температуры скорость окисления возрастает и может начаться горение. Животные и растения получают необходимую для жизни энергию за счет биологического окисления различных веществ кислородом, поступающим в организмы при дыхании. Самый распространенный на Земле элемент . в виде соединений составляет ок. 1/2 массы земной коры; входит в состав воды (88,8% по массе) и многих тканей живых организмов (ок. 70% по массе). Свободный кислород атмосферы (20,95% по объему) образовался и сохраняется благодаря фотосинтезу. Кислород (или обогащенный им воздух) применяется в металлургии, химической промышленности, в медицине, кислородно-дыхательный аппаратах. Жидкий кислород - компонент ракетного топлива. ФТОР (лат. Fluorum) - F, химический элемент VII группы периодической системы Менделеева, атомный номер 9, атомная масса 18,998403, относится к галогенам. Бледно-желтый газ с резким запахом, tпл ?219,699 .С, tкип ?188,200 .С, плотность 1,70 г/см³. Самый активный неметалл: реагирует со всеми элементами, кроме гелия, неона и аргона. Взаимодействие фтора со многими веществами легко переходит в горение и взрыв. Фтор разрушает многие материалы (отсюда название: греч. phthoros - разрушение). Главные минералы - флюорит, криолит, фторапатит. Применяют фтор для получения фторорганических соединений и фторидов; фтор входит в состав тканей живых организмов (кости, зубная эмаль).
F
Кислород,фтор
КИСЛОРОД (лат. Oxygenium) - О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций - О2 ("обычный" кислород) и О3 (озон). О2 - газ без цвета и запаха, плотность 1,42897 г/л, tпл -218,6 .С, tкип -182,96 .С. Химически самый активный (после фтора) неметалл. С большинством других элементов (водородом, галогенами, серой, многими металлами и т. д.) взаимодействует непосредственно (окисление) и, как правило, с выделением энергии. При повышении температуры скорость окисления возрастает и может начаться горение. Животные и растения получают необходимую для жизни энергию за счет биологического окисления различных веществ кислородом, поступающим в организмы при дыхании. Самый распространенный на Земле элемент . в виде соединений составляет ок. 1/2 массы земной коры; входит в состав воды (88,8% по массе) и многих тканей живых организмов (ок. 70% по массе). Свободный кислород атмосферы (20,95% по объему) образовался и сохраняется благодаря фотосинтезу. Кислород (или обогащенный им воздух) применяется в металлургии, химической промышленности, в медицине, кислородно-дыхательный аппаратах. Жидкий кислород - компонент ракетного топлива. ФТОР (лат. Fluorum) - F, химический элемент VII группы периодической системы Менделеева, атомный номер 9, атомная масса 18,998403, относится к галогенам. Бледно-желтый газ с резким запахом, tпл ?219,699 .С, tкип ?188,200 .С, плотность 1,70 г/см³. Самый активный неметалл: реагирует со всеми элементами, кроме гелия, неона и аргона. Взаимодействие фтора со многими веществами легко переходит в горение и взрыв. Фтор разрушает многие материалы (отсюда название: греч. phthoros - разрушение). Главные минералы - флюорит, криолит, фторапатит. Применяют фтор для получения фторорганических соединений и фторидов; фтор входит в состав тканей живых организмов (кости, зубная эмаль).
Слайд 7

Хлор, бром
ХЛОР (лат. Chlorum) - Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453, относится к галогенам. Название от греч. chloros - желто-зеленый. Газ желто-зеленого цвета с резким запахом; плотность 3,214 г/л; tпл ?101 .С; tкип ?33,97 .С; при обычной температуре легко сжижается под давлением 0,6 МПа. Химически очень активен (окислитель). Главные минералы - галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и др. элементов. Применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбелки целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. Токсичен. БРОМ (лат. Bromum) - Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам. Назван от греч. bromos - зловоние. Тяжелая красно-бурая дымящая на воздухе жидкость с резким неприятным запахом; плотность 3,1 г/см³, tпл -7,25 .С, tкип 59,2 .С. Применяют как бромирующий агент, для получения бромидов, органических и других соединений брома, в аналитической химии. Бром ядовит.
ХЛОР (лат. Chlorum) - Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453, относится к галогенам. Название от греч. chloros - желто-зеленый. Газ желто-зеленого цвета с резким запахом; плотность 3,214 г/л; tпл ?101 .С; tкип ?33,97 .С; при обычной температуре легко сжижается под давлением 0,6 МПа. Химически очень активен (окислитель). Главные минералы - галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и др. элементов. Применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбелки целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. Токсичен. БРОМ (лат. Bromum) - Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам. Назван от греч. bromos - зловоние. Тяжелая красно-бурая дымящая на воздухе жидкость с резким неприятным запахом; плотность 3,1 г/см³, tпл -7,25 .С, tкип 59,2 .С. Применяют как бромирующий агент, для получения бромидов, органических и других соединений брома, в аналитической химии. Бром ядовит.
Слайд 8

БЛАГОРОДНЫЕ ГАЗЫ
БЛАГОРОДНЫЕ ГАЗЫ (инертные газы) - химические элементы: гелий Не, неон Ne, аргон Ar, криптон Kr, ксенон Хе, радон Rn; относятся к VIII группе периодической системы. Одноатомные газы без цвета и запаха. В небольших количествах присутствуют в воздухе, содержатся в некоторых минералах, природных газах, в растворенном виде - в воде. Обнаружены также в атмосферах планет-гигантов. До 1962 считались абсолютно химически инертными, однако позже получен ряд производных Ar, Ne, Xe, Kr и Rn (фтороксиды, фториды, соединения включения).
БЛАГОРОДНЫЕ ГАЗЫ (инертные газы) - химические элементы: гелий Не, неон Ne, аргон Ar, криптон Kr, ксенон Хе, радон Rn; относятся к VIII группе периодической системы. Одноатомные газы без цвета и запаха. В небольших количествах присутствуют в воздухе, содержатся в некоторых минералах, природных газах, в растворенном виде - в воде. Обнаружены также в атмосферах планет-гигантов. До 1962 считались абсолютно химически инертными, однако позже получен ряд производных Ar, Ne, Xe, Kr и Rn (фтороксиды, фториды, соединения включения).
Слайд 9

Бор, углерод
БОР (др.-исл. рожденный) - в скандинавской мифологии один из богов-прародителей, сын первочеловека Бури, отец Одина. УГЛЕРОД (лат. Carboneum) - С, химический. элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Основные кристаллические модификации - алмаз и графит. При обычных условиях углерод химически инертен; при высоких температурах соединяется с многими элементами (сильный восстановитель). Содержание углерода в земной коре 6,5.1016 т. Значительное количество углерода (ок. 1013 т) входит в состав горючих ископаемых (уголь, природный газ, нефть и др.), а также в состав углекислого газа атмосферы (6.1011 т) и гидросферы (1014 т). Главные углеродсодержащие минералы - карбонаты. Углерод обладает уникальной способностью образовывать огромное количество соединений, которые могут состоять практически из неограниченного числа атомов углерода. Многообразие соединений углерода определило возникновение одного из основных разделов химии - органической химии. Углерод - биогенный элемент; его соединения играют особую роль в жизнедеятельности растительных и животных организмов (среднее содержание углерода - 18%). Углерод широко распространен в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
БОР (др.-исл. рожденный) - в скандинавской мифологии один из богов-прародителей, сын первочеловека Бури, отец Одина. УГЛЕРОД (лат. Carboneum) - С, химический. элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Основные кристаллические модификации - алмаз и графит. При обычных условиях углерод химически инертен; при высоких температурах соединяется с многими элементами (сильный восстановитель). Содержание углерода в земной коре 6,5.1016 т. Значительное количество углерода (ок. 1013 т) входит в состав горючих ископаемых (уголь, природный газ, нефть и др.), а также в состав углекислого газа атмосферы (6.1011 т) и гидросферы (1014 т). Главные углеродсодержащие минералы - карбонаты. Углерод обладает уникальной способностью образовывать огромное количество соединений, которые могут состоять практически из неограниченного числа атомов углерода. Многообразие соединений углерода определило возникновение одного из основных разделов химии - органической химии. Углерод - биогенный элемент; его соединения играют особую роль в жизнедеятельности растительных и животных организмов (среднее содержание углерода - 18%). Углерод широко распространен в космосе; на Солнце он занимает 4-е место после водорода, гелия и кислорода.
Слайд 10

Кремний, фосфор
КРЕМНИЙ (лат. Silicium) - Si, химический элемент IV группы периодической системы, атомный номер 14, атомная масса 28,0855. Темно-серые кристаллы с металлическим блеском; плотность 2,33 г/см³, tпл 1415 .С. Стоек к химическим воздействиям. Составляет 27,6% массы земной коры (2-е место среди элементов), главные минералы - кремнезем и силикаты. Один из важнейших полупроводниковых материалов (транзисторы, термисторы, фотоэлементы). Составная часть многих сталей и других сплавов (повышает механическую прочность и устойчивость к коррозии, улучшает литейные свойства). ФОСФОР (лат. Phosphorus) - Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376. Название от греч. phosphoros - светоносный. Образует несколько модификаций - Белый фосфор (плотность 1,828 г/см³, tпл 44,14 .С), красный фосфор (плотность 2,3 г/см³, tпл 590 .С) и др. Белый фосфор легко самовоспламеняется, светится в темноте (отсюда название), ядовит; красный менее активен химически, ядовит. Добывают из апатитов и фосфоритов. Главный потребитель - сельское хозяйство (фосфорные удобрения); применяется в спичечном производстве, металлургии (раскислитель и компонент некоторых сплавов), в органическом синтезе и др. Присутствует в живых клетках в виде орто- и пирофосфорной кислот.
Слайд 11

Мышьяк, сера
МЫШЬЯК (лат. Arsenicum) - As, химический элемент V группы периодической системы, атомный номер 33, атомная масса 74,9216. Русское название от "мышь" (препараты мышьяка применялись для истребления мышей и крыс). Образует несколько модификаций. Обычный мышьяк (т. н. металлический, или серый) - хрупкие кристаллы с серебристым блеском; плотность 5,74 г/см³, при 615 .С возгоняется. На воздухе окисляется и тускнеет. Добывают из сульфидных руд (минералы арсенопирит, аурипигмент, реальгар). Компонент сплавов с медью, свинцом, оловом и др. и полупроводниковых материалов. соединения мышьяка физиологически активны и ядовиты; служили одними из первых инсектицидов (см., напр., Арсенаты металлов). Неорганические соединения мышьяка применяются в медицине как общеукрепляющие, тонизирующие средства, органические - как противомикробные и противопротозойные (при лечении сифилиса, амебиаза и др.). СЕРА (лат. Sulfur) - S, химический элемент VI группы периодической системы Менделеева, атомный номер 16, атомная масса 32,066. Желтые кристаллы. Устойчива в двух модификациях - ромбической (плотность 2,07 г/см³, tпл 112,8 .С) и моноклинной (плотность 1,96 г/см³, tпл 119,0 .С). В воде нерастворима. На воздухе устойчива; при горении дает SO2, с металлами образует сульфиды. В природе - самородная сера, сульфиды, сульфаты. Серу выплавляют из самородных руд; получают также окислением кислородом воздуха сероводорода, содержащегося в природном, нефтяном, коксовом газах, и др. методами. Ок. 50% серы идет на получение серной кислоты, 25% - на получение сульфитов (используются в бумажной промышленности), остальная - для борьбы с болезнями растений, вулканизации, синтеза красителей, производства спичек и др.
МЫШЬЯК (лат. Arsenicum) - As, химический элемент V группы периодической системы, атомный номер 33, атомная масса 74,9216. Русское название от "мышь" (препараты мышьяка применялись для истребления мышей и крыс). Образует несколько модификаций. Обычный мышьяк (т. н. металлический, или серый) - хрупкие кристаллы с серебристым блеском; плотность 5,74 г/см³, при 615 .С возгоняется. На воздухе окисляется и тускнеет. Добывают из сульфидных руд (минералы арсенопирит, аурипигмент, реальгар). Компонент сплавов с медью, свинцом, оловом и др. и полупроводниковых материалов. соединения мышьяка физиологически активны и ядовиты; служили одними из первых инсектицидов (см., напр., Арсенаты металлов). Неорганические соединения мышьяка применяются в медицине как общеукрепляющие, тонизирующие средства, органические - как противомикробные и противопротозойные (при лечении сифилиса, амебиаза и др.). СЕРА (лат. Sulfur) - S, химический элемент VI группы периодической системы Менделеева, атомный номер 16, атомная масса 32,066. Желтые кристаллы. Устойчива в двух модификациях - ромбической (плотность 2,07 г/см³, tпл 112,8 .С) и моноклинной (плотность 1,96 г/см³, tпл 119,0 .С). В воде нерастворима. На воздухе устойчива; при горении дает SO2, с металлами образует сульфиды. В природе - самородная сера, сульфиды, сульфаты. Серу выплавляют из самородных руд; получают также окислением кислородом воздуха сероводорода, содержащегося в природном, нефтяном, коксовом газах, и др. методами. Ок. 50% серы идет на получение серной кислоты, 25% - на получение сульфитов (используются в бумажной промышленности), остальная - для борьбы с болезнями растений, вулканизации, синтеза красителей, производства спичек и др.
Слайд 12

Селен, теллур.
СЕЛЕН (лат. Selenium) - Se, химический элемент VI группы периодической системы Менделеева, атомный номер 34, атомная масса 78,96. Название от греческого selene - Луна. Образует несколько модификаций. Наиболее устойчив серый селен - кристаллы, плотность 4,807 г/см³, tпл 221 .С. В природе рассеян, сопутствует сере, добывают из отходов (шламов) при электролитической очистке меди. Полупроводник, обладающий фотоэлектрическими свойствами. Селеновые фотоэлементы применяют в различных устройствах, напр. фотоэлектрических экспонометрах. Все соединения селена ядовиты ТЕЛЛУР (лат. Tellurium) - Те, химический элемент VI группы периодической системы, атомный номер 52, атомная масса 127,60. Название от лат. tellus род. п. telluris - Земля. Серебристо-серые, очень хрупкие кристаллы с металлическим блеском, плотность 6,24 г/см³, tпл 450 .С; полупроводник. На воздухе устойчив, при высокой температуре горит с образованием диоксида ТеО2. В природе встречается в виде теллуридов и как самородный теллур; часто сопутствует сере и селену; добывают из отходов электролиза меди. Компонент сплавов (меди, свинца, литейного чугуна); краситель для стекла и керамики (коричневый цвет). Многие соединения теллура - полупроводниковые материалы, приемники инфракрасного излучения
СЕЛЕН (лат. Selenium) - Se, химический элемент VI группы периодической системы Менделеева, атомный номер 34, атомная масса 78,96. Название от греческого selene - Луна. Образует несколько модификаций. Наиболее устойчив серый селен - кристаллы, плотность 4,807 г/см³, tпл 221 .С. В природе рассеян, сопутствует сере, добывают из отходов (шламов) при электролитической очистке меди. Полупроводник, обладающий фотоэлектрическими свойствами. Селеновые фотоэлементы применяют в различных устройствах, напр. фотоэлектрических экспонометрах. Все соединения селена ядовиты ТЕЛЛУР (лат. Tellurium) - Те, химический элемент VI группы периодической системы, атомный номер 52, атомная масса 127,60. Название от лат. tellus род. п. telluris - Земля. Серебристо-серые, очень хрупкие кристаллы с металлическим блеском, плотность 6,24 г/см³, tпл 450 .С; полупроводник. На воздухе устойчив, при высокой температуре горит с образованием диоксида ТеО2. В природе встречается в виде теллуридов и как самородный теллур; часто сопутствует сере и селену; добывают из отходов электролиза меди. Компонент сплавов (меди, свинца, литейного чугуна); краситель для стекла и керамики (коричневый цвет). Многие соединения теллура - полупроводниковые материалы, приемники инфракрасного излучения
Слайд 13

Йод, астат.
ИОД (йод) (лат. Iodum) - I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045, относится к галогенам. Черно-серые кристаллы с металлическим блеском; плотность 4,94 г/см³, tпл 113,5 .С, tкип 184,35 .С. Уже при обычной температуре испаряется, при слабом нагревании возгоняется. В воде растворяется плохо, лучше - в органических растворителях. Промышленное сырье - соединения иода, содержащиеся в буровых водах, морской воде. Главный потребитель - медицина: многие фармацевтические препараты, бытовой "иод" (раствор иода в спирте), радиоактивный изотоп (диагностика и лечение щитовидной железы и др.). Название от греч. iodes - фиолетовый (по цвету паров). АСТАТ (лат. Astatium) - At, химический элемент VII группы периодической системы, атомный номер 85, атомная масса 209, 9871, относится к галогенам. Радиоактивен, наиболее устойчивый изотоп 210At (период полураспада 8,1 ч). Название от греч. astatos - неустойчивый (не имеет долгоживущих изотопов). По одним свойствам напоминает неметалл иод, по другим - металл полоний.
ИОД (йод) (лат. Iodum) - I, химический элемент VII группы периодической системы, атомный номер 53, атомная масса 126,9045, относится к галогенам. Черно-серые кристаллы с металлическим блеском; плотность 4,94 г/см³, tпл 113,5 .С, tкип 184,35 .С. Уже при обычной температуре испаряется, при слабом нагревании возгоняется. В воде растворяется плохо, лучше - в органических растворителях. Промышленное сырье - соединения иода, содержащиеся в буровых водах, морской воде. Главный потребитель - медицина: многие фармацевтические препараты, бытовой "иод" (раствор иода в спирте), радиоактивный изотоп (диагностика и лечение щитовидной железы и др.). Название от греч. iodes - фиолетовый (по цвету паров). АСТАТ (лат. Astatium) - At, химический элемент VII группы периодической системы, атомный номер 85, атомная масса 209, 9871, относится к галогенам. Радиоактивен, наиболее устойчивый изотоп 210At (период полураспада 8,1 ч). Название от греч. astatos - неустойчивый (не имеет долгоживущих изотопов). По одним свойствам напоминает неметалл иод, по другим - металл полоний.
Слайд 14

Неметаллы, их окислительные и восстановительные свойства
Чтобы выявить свойства, характерные для всех неметаллов, надо прежде всего обратить внимание на их расположение в периодической системе элементов Д. И. Менделеева и определить число электронов на внешнем энергетическом уровне атомов. Неметаллы в основном располагаются в конце малых и больших периодов, а число внешних электронов у их атомов равно номеру группы. Как известно, способность присоединять электроны в периоде возрастает по мере приближения к благородному газу, а в группе — по мере уменьшения радиуса атома или, иными словами, снизу вверх. Неметаллы проявляют окислительные свойства, то есть у них, в отличие от металлов, преобладает способность присоединять электроны. У элементов VI и VII групп эти свойства выражены наиболее сильно. Самым сильным окислителем является фтор. Окислительные свойства неметаллов зависят от значений их электроотрицательностей и увеличиваются в следующей последовательности: Si, B, H, P, C, S, I, N, Cl, O, F
Чтобы выявить свойства, характерные для всех неметаллов, надо прежде всего обратить внимание на их расположение в периодической системе элементов Д. И. Менделеева и определить число электронов на внешнем энергетическом уровне атомов. Неметаллы в основном располагаются в конце малых и больших периодов, а число внешних электронов у их атомов равно номеру группы. Как известно, способность присоединять электроны в периоде возрастает по мере приближения к благородному газу, а в группе — по мере уменьшения радиуса атома или, иными словами, снизу вверх. Неметаллы проявляют окислительные свойства, то есть у них, в отличие от металлов, преобладает способность присоединять электроны. У элементов VI и VII групп эти свойства выражены наиболее сильно. Самым сильным окислителем является фтор. Окислительные свойства неметаллов зависят от значений их электроотрицательностей и увеличиваются в следующей последовательности: Si, B, H, P, C, S, I, N, Cl, O, F
Слайд 15

Фтор, как самый активный неметалл, в химических реакциях никогда не проявляет восстановительных свойств, то есть не имеет способности отдавать электроны. Кислород в соединениях со фтором (OF2, O2F2) имеет положительную степень окисления и является восстановителем. Остальные неметаллы и соответствующие им простые вещества также могут иметь восстановительные свойства, которые у них проявляются намного слабее, чем у металлов. Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду O, Cl, N, I, S, C, P, H, B, Si Например, хлор непосредственно не взаимодействует с кислородом, однако косвенным путем можно получить оксиды хлора (Cl2O, ClO2, Cl2O7), в которых хлор проявляет положительную степень окисления. Азот же, как известно, при высоких температурах взаимодействует с кислородом, проявляя при этом восстановительные свойства: N2 + O2 2NO
Слайд 16

Сера проявляет как окислительные, так и восстановительные свойства. Она бурно вступает в реакцию с кислородом: S + O2 = SO2. При нагревании паров серы с водородом сера восстанавливается до H2S. В нормальных условиях неметаллы водород, фтор, хлор, кислород, азот и благородные газы — это газы, бром — жидкость, а остальные — твердые вещества. Свойства этих неметаллов также отличаются, что объясняется различием их кристаллической структуры. Немолекулярное строение имеют C, B, Si. Эти неметаллы образуют атомную кристаллическую решетку, благодаря чему они обладают большой твердостью и высокой температурой плавления. У кристаллического бора, как и у кристаллического кремния, очень высокая (2075° С) температура плавления и большая твердость. Электрическая проводимость бора увеличивается с повышением температуры, что широко позволяет использовать его в полупроводниковой технике. Добавление бора в состав стали, сплавов алюминия, меди, никеля приводит к улучшению их механических свойств. Изотоп бора используется в ядерной технике. Соединения бора с металлами (например, ТаВ, ТаВ2) называются боридами. Они применяются при изготовлении реактивных двигателей, лопастей газовых турбин. Углерод (С), кремний (Si), бор (B) имеют схожее строение и проявляют некоторые общие свойства. Простые вещества этих элементов имеют несколько аллотропных модификаций в кристаллическом и аморфном состоянии. Видоизменениям углерода (алмаз), кремния (Si) и бора (В) свойственны высокая твердость, высокая температура плавления и полупроводниковые свойства. Все эти элементы образуют соединения с металлами - карбиды (СаС2, Al2C3, Fe3C), силициды (Mg2Si) и бориды (TaB, TaB2).
Слайд 17

Молекулярное строение имеют F2, O2, Cl2, Br2, N2, I2, S8, P4. Эти вещества в твердом состоянии имеют молекулярную кристаллическую решетку. В обычных условиях они являются газами, жидкостями или твердыми веществами с низкой температурой кипения. Взаимодействуя с металлами, типичные неметаллы образуют соединения с ионной связью, например, хлорид натрия NaCI, оксид кальция СаО, сульфид калия K2S. В определенных условиях неметаллы реагируют между собой, образуя соединения с ковалентной связью — как полярные, так и неполярные. Примерами первых служат вода Н2О, хлороводород НСl, аммиак NH3, примерами вторых — оксид углерода (IV) СО2, метан СН4.
Слайд 18

Дополнительно:
Слайд 19

ребусы
Слайд 20

(Никель, азот, бор, марганец,, мышьяк, углерод.)
Слайд 21

Олово. астат, Ванадий, висмут, Радий, титан.
Слайд 22
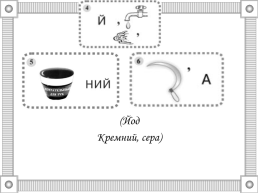
(Йод Кремний, сера)
Слайд 23

Шуточные загадки
Слайд 24

1. Какой элемент вращается вокруг Солнца? (Уран.)
2. Какой металл по древнегреческой мифологии «обречен» на вечные муки? (Тантал.)
3. В состав какого металла входит дерево? (Никель.)
4. Какой благородный металл состоит из болотных водорослей? (Платина.)
5. Частью какого химического элемента любят играть на досуге взрослые и дети? (Золото.)
6. Как из меди и мышьяка получить золото? (Сu + Аs = Au + Cs.)
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
