Слайды и текст этой онлайн презентации
Слайд 1
Тема урока: «Растворение. Растворимость веществ в воде.»
Знания составляются из мелких крупинок
ежедневного опыта
(Д.И. Писарев)
Цели урока: Познакомится с растворением как физико-химическим процессом и с растворами как физико-химическими системами. Познакомится классификацией растворов по признаку растворимости.
Слайд 2
Проверка пройденного материала
Фронтальный опрос
1. Чем отличается друг от друга обратимые и необратимые реакции?
2. В чем заключается сущность правила Бертолле?
3. Что означает понятие «химическое равновесие» и когда оно наступает?
4. В чем заключается сущность принципа Ле – Шаталье?
5. От каких условий зависит химическое равновесие?
Упражнение: Определите тип химической реакции?
Как нужно изменить условия реакции для смещения химического равновесия вправо:
2SO2 +O2 kat 2SO3 +Q
Слайд 3
Объяснение нового материала
Растворение. Растворы
Физическая теория Химическая теория
(Вант-Гофф, Ост- (Менделеев, Каблуков,
вальд, Аррениус). Кистяковский).
Растворение –это Растворение –это процесс процесс диффузии, химического взаимодействия
а растворы – это растворяемого вещества с
однородные смеси водой – процесс гидратации, а соединения - гидраты растворы – это соединения -
гидраты
Слайд 4
Современная теория
Растворение – это физико-химический процесс, а растворы – это однородная (гомогенная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия – гидратов
непостоянный постоянный состав в
состав в кристаллогидратах
растворах (CuSO4 *5H2O,Na2 SO4 *10H2O)
Слайд 5
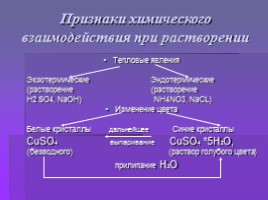
Признаки химического взаимодействия при растворении
Тепловые явления
Экзотермические Эндотермические
(растворение (растворение
H2 SO4, NaOH) NH4NO3, NaCL)
Изменение цвета
Белые кристаллы дальнейшее Синие кристаллы
CuSO4 выпаривание CuSO4 *5H2O,
(безводного) (раствор голубого цвета)
прилипание H2O
Слайд 6
Факторы, от которых зависит растворимость твердых веществ
От природы веществ(на 1г. H2O при 20C )
Хорошо растворимые Практически нерастворимые
( более 1г.) (меньше 0,01г.)
Малорастворимые
(менее 1 г.)
От температуры
Р
Н
М
Слайд 7
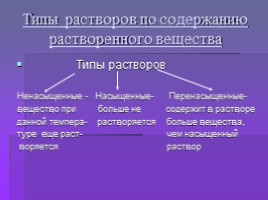
Типы растворов по содержанию растворенного вещества
Типы растворов
Ненасыщенные - Насыщенные- Перенасыщенные-
вещество при больше не содержит в растворе
данной темпера- растворяется больше вещества,
туре еще раст- чем насыщенный
воряется раствор
Слайд 8
Закрепление нового материала
задание №7 на 142 странице
Слайд 9
РЕШЕНИЕ ЗАДАЧИ
Дано: Решение
m( p-pa) =500г.
t(растворения) =20С MgSO4 +BaCL2 = BaSO4+MgCL2
Если при20 С в100г. р-ра -38г. р.в
Найти то в 500г. р-ра –х г. р.в
m(осадка) хг. = 500*38: 100= 190г.
М(BaSO4)=137+32+16*4=233г./моль
М(MgSO4)= 24+32+16*4= 120г./моль
190г. = хг
120г. 233г. Х = 190* 233:120=369г.
ответ: m(BaSO4)=369г.
Слайд 10
Домашняя работа
параграф 34 стр.136 – 142
упражнение 5 стр.142
 Практическая работа «Приготовление раствора с определенной массовой долей Растворенного Вещества»
Практическая работа «Приготовление раствора с определенной массовой долей Растворенного Вещества» Правила обращения с веществами и лабораторным оборудованием
Правила обращения с веществами и лабораторным оборудованием Окружающий мир 3 класс «Из чего состоит вещество?»
Окружающий мир 3 класс «Из чего состоит вещество?» Тест: «Строение вещества»
Тест: «Строение вещества» Простые вещества - металлы
Простые вещества - металлы Урок окружающего мира в 1 классе «На суше и в воде 2 часть»
Урок окружающего мира в 1 классе «На суше и в воде 2 часть» Урок окружающего мира в 1 классе «На суше и в воде»
Урок окружающего мира в 1 классе «На суше и в воде»