Слайды и текст этой онлайн презентации
Слайд 1
Атом – сложная частица
11 класс
Слайд 2
Цели и задачи
Познакомить учащихся с эволюцией научных взглядов на строение атома
Показать взаимодействие наук физики и химии
Слайд 3
Представления о строении атома
Атом – «неделимая» частица химического элемента
Доказательства сложности строения атома
Открытие катодных лучей (1897г., Дж. Томсон)
Открытие рентгеновских лучей (1895г., К. Рентген),
явления фотоэффекта 1889 г., А.Г. Столетов)
3.Открытие радиактивности (1896 г.,А. Беккерель) и её изучение
(1897-1903 гг., супруги М. Склодовская- Кюри и П. Кюри)
Слайд 4
СЛОВО «АТОМ» ПРИДУМАЛ БОЛЕЕ 2500 ЛЕТ НАЗАД ДРЕВНЕГРЕЧЕСКИЙ ФИЛОСОФ ДЕМОКРИТ
АТОМ – ЭТО МЕЛЬЧАЙШАЯ ХИМИЧЕСКИ НЕДЕЛИМАЯ ЧАСТИЦА ВЕЩЕСТВА
Слайд 5
Представления о строении атома
Классическая теория строения атома
Модели строения атома:
1. «Пудинг с изюмом» (1902-1904 гг.,Дж. Томсон и В. Кельвин
2. Планетарная модель (1907г., Э. Резерфорд)
3. Модель Бора (1913)
Современные представления
о строении атома
на основе квантовой механики
Слайд 6
МОДЕЛЬ АТОМА ТОМСОНА
Атом, по мысли Дж. Томсона, очень похож на пудинг с изюмом: электроны, как "изюминки", а "каша" - положительно заряженное вещество атома .
Джозеф Джон ТОМСОН
Слайд 8
Постулаты Н. Бора
электроны в атоме вращаются по строго определённым замкнутым орбитам, не испуская и не поглощая энергии;
при переходе электронов с
одной орбиты на другую
происходит поглощение
или выделение энергии.
Слайд 9
Современная квантовая модель
Н. Бор - создатель первой квантовой теории атома и активный участник разработки основ квантовой механики. Также он внёс значительный вклад в развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой.
Электрон имеет двойственную (корпускулярно-волновую природу) -28 -19
Масса = 9,1*10 г ; заряд =1,6*10 Кл
Движущийся электрон обладает свойствами волны (способность к дифракции интерференции)
Слайд 10
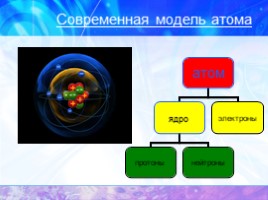
Современная модель атома
Слайд 12
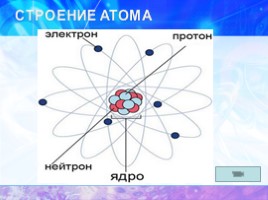
СТРОЕНИЕ АТОМА
протоны
нейтроны
электроны
атом
ядро
электронная
оболочка
Слайд 13
Z – порядковый номер химического элемента
A – массовое число, A=Ar
N – число нейтронов
Слайд 14
Число p Z p = Z (порядковому номеру химического элемента)
Число ē Z ē = Z (порядковому номеру химического элемента)
Число n N = A – Z (массовое число минус порядковый номер химического элемента)
+
+
о
Слайд 16
Нуклиды -
различные виды атомов.
Нуклиды характеризуются массовым числом А и зарядом ядра Z.
Изотопы - нуклиды с одинаковыми Z, но разными А
Изобары – нуклиды с разными Z, но одинаковыми А
Слайд 17
Задание 1. Запишите для 2-3
элементов (по вашему выбору).
Элемент
Порядковый номер
Относительная атомная масса
Заряд ядра атома
Число протонов
Число нейтронов
Число электронов
Проверяем знания
Слайд 18
Задание 2. Выполните следующие упражнения
Назовите элемент, содержащий 23 протона.
Назовите элементы II периода, содержащие 8 нейтронов и запишите их.
Назовите и запишите символы элементов, в которых сумма протонов и нейтронов равна 40.
В ядре атома химического элемента А содержится 11 протонов и 12 нейтронов, а в ядре атома химического элемента В – 12 протонов и 12 нейтронов.
Определите, являются ли они:
а) изотопами одного элемента;
б) атомами двух химических элементов, у которых одинаковое массовое число;
в) атомами двух разных элементов, находящихся в периодической системе рядом.
Проверяем знания
Слайд 19
Задание 3. Определить состав изотопов
35Cl и 37Cl
28Si , 29Si, 30Si
39Ar, 40Ar
Проверяем знания
Слайд 20
«Строение атома», презентация автор Беземская И.В. учитель химии МОУ «СОШ №2 п.Сенной Вольского района Саратовской области»
http://ru.wikipedia.org/wiki/
http://www.chem.msu.su/rus/teaching/
 Атом - сложная частица
Атом - сложная частица Постулаты Бора - Модель атома водорода по Бору
Постулаты Бора - Модель атома водорода по Бору Строение атома
Строение атома Частица как часть речи - Формообразующие частицы
Частица как часть речи - Формообразующие частицы Различение частиц НЕ и НИ - Основные случаи употребления
Различение частиц НЕ и НИ - Основные случаи употребления Строение атома. Химия 7 класс тренажёр
Строение атома. Химия 7 класс тренажёр Топографическая анатомия и оперативная хирургия общего желчного протока
Топографическая анатомия и оперативная хирургия общего желчного протока