Слайды и текст этой онлайн презентации
Слайд 1
Строение атома 11 класс
Слайд 2
Первая гипотеза строения атома предложена английским учёным Томсоном(1904)-статическая или электронно-ионная теория
Слайд 3
Для проверки гипотезы Томсона Резерфорд (1911) провёл серию опытов по рассеиванию альфа -частиц тонкими металлическими пластинами.
Слайд 4
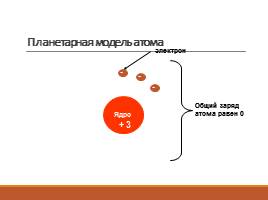
Планетарная модель атома
электрон
+
Общий заряд атома равен 0
-
3
-
-
Слайд 6
-
Сравнение размеров ядра и электрона
Слайд 7
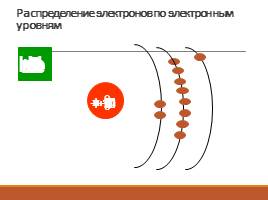
Распределение электронов по электронным уровням
Н
+ 1
Не
+ 2
Li
+ 3
+ 4
Be
B
+ 5
C
+ 6
N
+ 7
O
+ 8
F
+ 9
Ne
+ 10
Na
+ 11
Слайд 8
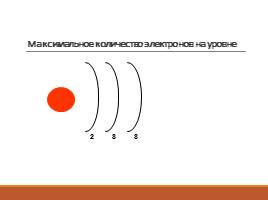
Максимальное количество электронов на уровне
Слайд 9
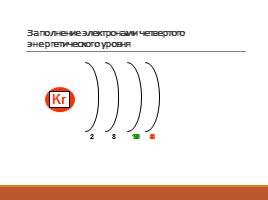
Заполнение электронами четвертого энергетического уровня
8
1
K
Ca
Sc
Ti
2
9
10
Zn
18
Ga
3
Ge
4
Kr
8
Слайд 10
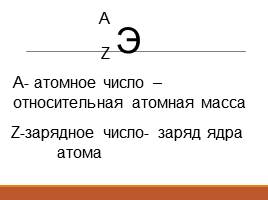
Э
Z
А
А- атомное число –
относительная атомная масса
Z-зарядное число- заряд ядра
атома
Слайд 11
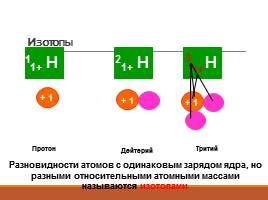
Изотопы
Изотопы − атомы с одинаковыми значениями Z, но различными А то есть разное число нейтронов n0
Слайд 12
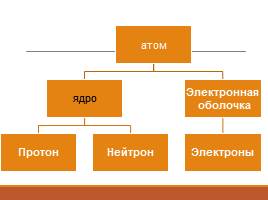
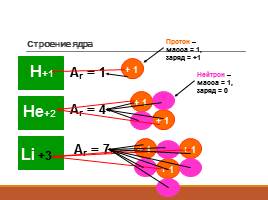
Строение ядра
Аr = 1
Аr = 4
Аr = 7
Протон – масса = 1, заряд = +1
Нейтрон – масса = 1, заряд = 0
+3
Слайд 13
Изотопы
Протон
Дейтерий
Тритий
1+
3
Разновидности атомов с одинаковым зарядом ядра, но разными относительными атомными массами называются изотопами
Слайд 14
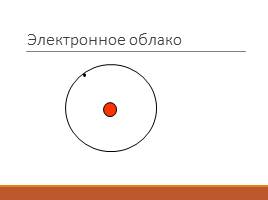
Электронное облако
Слайд 15
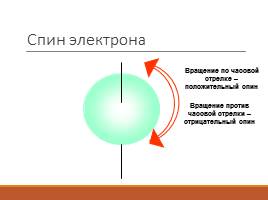
Спин электрона
Вращение по часовой стрелке – положительный спин
Вращение против часовой стрелки – отрицательный спин
Слайд 16
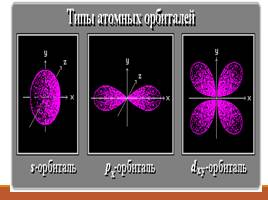
Формы электронных облаков
Сферическая форма
(S - электронное облако)
Форма объемной восьмерки (p – электронное облако)
Перекрещенные объемные восьмерки
(d – электронное облако)
Слайд 19
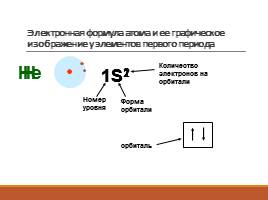
Электронная формула атома и ее графическое изображение у элементов первого периода
Н
1S1
Номер уровня
Форма орбитали
Количество электронов на орбитали
Не
1S2
орбиталь
Слайд 20
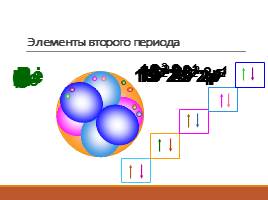
Элементы второго периода
Li
1S2 2S1
Be
1S2 2S2
B
1S2 2S2 2p1
C
1S2 2S2 2p2
N
1S2 2S2 2p3
O
1S2 2S2 2p4
F
1S2 2S2 2p5
Ne
1S2 2S2 2p6
Слайд 21
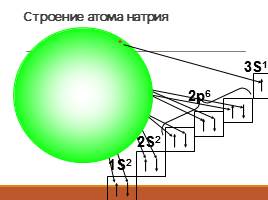
Na
Строение атома натрия
2S2
2p6
3S1
1S2
Слайд 22
Изменение внешнего электронного уровня у элементов третьего периода
Mg 3S2
Na 3S1
Al 3S2 3p1
Si 3S2 3p2
P 3S2 3p3
S 3S2 3p4
Cl 3S2 3p5
Ar 3S2 3p6
Слайд 23
Распределение электронных подуровней
Слайд 24
Электронная формула
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 4f 5d 5f……7f
Cu - 1s2 2s2 2p6 3s2 3p6 4s1 3d10
S - 1s2 2s2 2p 6 3s2 3p4
Se - 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
Слайд 25
Валентные электроны
S - 1s2 2s2 2p 6 3s 3p
2
4
Se - 1s2 2s2 2p6 3s2 3p6 4s2 3d104p4
Na - 1s2 2s2 2p6 3s1
Слайд 26
Точный "адрес" электрона в оболочке определяется с помощью
квантовых чисел.
n- главное квантового числа
принимать только целые значения- номер уровня
n 1 2 3 4 5 6 7
K L M N O P Q
Слайд 27
ℓ-орбитальное квантовое число, номер для подуровня
ℓ-изменяется от 0 до n-1
ℓ= 0 – это s-подуровень,
ℓ = 1 – это p-подуровень,
ℓ= 2 – это d-подуровень,
ℓ = 3 – это f-подуровень
Слайд 28
Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве,
связано с ℓ
и может принимать целочисленные значения ℓ
от –l до +l через 0.
d электронов
ℓ = 2,
ml = –2, –1, 0, +1, +2.
Слайд 29
Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси.
Может принимать значения +½ и –½
ms = +1/2
ms = - 1/2
,
Слайд 30
Принцип Паули или запрета :
Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел.
Правило Клечковского:
Энергия уровней и подуровней возрастает в порядке увеличения суммы n + l,
а при одном и том же значении этой суммы ниже располагаются уровни с меньшим n.
Слайд 31
Правило Хунда (Гунда) –
суммарное значение
спинового квантового числа электронов -должно быть максимальным.
 Строение атома. Химия 7 класс тренажёр
Строение атома. Химия 7 класс тренажёр Физика 9 класс «Строение атома»
Физика 9 класс «Строение атома» Тема урока. Делимость электрического заряда. Строение атома. Электрон. Объяснение электрических явлений
Тема урока. Делимость электрического заряда. Строение атома. Электрон. Объяснение электрических явлений Строение атома
Строение атома Строение атома (лекция)
Строение атома (лекция) Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов
Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов Строение ароматических углеводородов - Ароматическая связь
Строение ароматических углеводородов - Ароматическая связь