Слайды и текст этой онлайн презентации
Слайд 2
Строение атома
Опыт Эрнеста Резерфорда
Модель строения атома
Элементарный состав атома
Характеристика частиц, входящих в состав атома
Фундаментальные законы микромира
Слайд 3
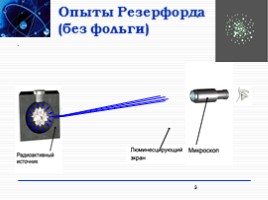
Опыты Резерфорда (без фольги)
3
Слайд 4
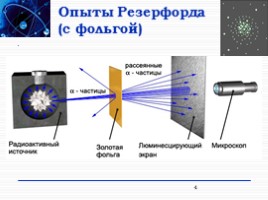
Опыты Резерфорда (с фольгой)
4
Слайд 5
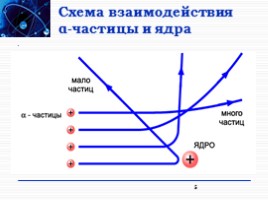
Схема взаимодействия α-частицы и ядра
5
Слайд 6
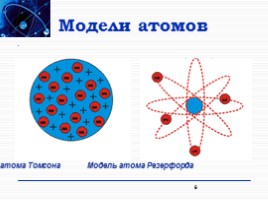
Модели атомов
6
Модель атома Томсона
Модель атома Резерфорда
Слайд 7
Характеристики атомного ядра
Z – зарядовое число,
A – массовое число,
N – число нейтронов
в ядре
A = Z + N
Z
A
X
A
Z
7
Слайд 8
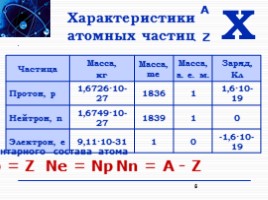
Характеристики атомных частиц
Частица Масса,
кг Масса, me Масса,
а. е. м. Заряд,
Кл
Протон, p 1,6726·10-27 1836 1 1,6·10-19
Нейтрон, n 1,6749·10-27 1839 1 0
Электрон, e 9,11·10-31 1 0 -1,6·10-19
Определение элементарного состава атома
Np = Z
Ne = Np
Nn = A - Z
8
Слайд 9
Ra
226
88
Rn
222
86
He
4
2
Превращения атомных ядер
226 = 222 + 4
88 = 86 + 2
Выполняются законы сохранения
массового
чисел
и зарядового
Реакция α-распада ядра радия:
9
Слайд 10
Сочинить синквейн по плану:
1 строка – тема или предмет (одно существительное);
2 строка – описание предмета (два прилагательных);
3 строка – описание действия (три глагола);
4 строка – фраза из четырех слов, выражающая
отношение к предмету;
5 строка – синоним, обобщающий или расширяющий смысл темы.
10
Слайд 11
Реши задачу
1. Явление радиоактивности, открытое Беккерелем, свидетельствует о том, что …
А. Все вещества состоят из неделимых частиц-атомов.
Б. В состав атома входят электроны.
В. Атом имеет сложную структуру.
Г. Это явление характерно только для урана.
11
Слайд 12
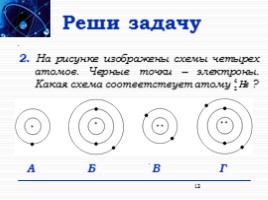
Реши задачу
2. На рисунке изображены схемы четырех атомов. Черные точки – электроны. Какая схема соответствует атому ?
А Б В Г
12
Слайд 13
Реши задачу
3. В состав атома входят следующие частицы:
А. Только протоны.
Б. Нуклоны и электроны.
В. Протоны и нейтроны.
Г. Нейтроны и электроны.
13
Слайд 14
Реши задачу
4. Чему равно массовое число ядра атома марганца Mn?
А. 25.
Б. 80.
В. 30.
Г. 55.
14
Слайд 15
Реши задачу
5. В каких из следующих реакций нарушен закон сохранения заряда?
А.
Б.
В.
Г.
15
Слайд 16
Реши задачу
6. Массы протона и нейтрона …
А. Относятся как 1836:1.
Б. Приблизительно одинаковы.
В. Относятся как 1: 1836.
Г. Приблизительно равны нулю.
16
Слайд 17
Реши задачу
6. В ядре атома кальция содержится …
А. 20 нейтронов и 40 протонов.
Б. 40 нейтронов и 20 электронов.
В. 20 протонов и 40 электронов.
Г. 20 протонов и 20 нейтронов.
17
Слайд 18
Реши задачу
7. Какой вид радиоактивного излучения наиболее опасен при внешнем облучении человека?
А. Бета-излучение.
Б. Гамма-излучение.
В. Альфа-излучение.
Г. Все три вида излучения: альфа, бета, гамма.
18
Слайд 19
Домашнее задание
§ 66, 67.
Выполнить (по желанию) творческое задание по теме «Строение атома» :
Составить кроссворд;
Сочинить синквейн по плану:
1 строка – тема или предмет (одно существительное);
2 строка – описание предмета (два прилагательных);
3 строка – описание действия (три глагола);
4 строка – фраза из четырех слов, выражающая отношение к
предмету;
5 строка – синоним, обобщающий или расширяющий смысл темы.
19
Слайд 20
Электронные адреса использованных Интернет-ресурсов:
20
Анимация со звуком «Опыт Резерфорда»:
Видеоролик - анимация "Планетарная модель атома":
Слайд 21
Томсон Джозеф Джон
(1856 - 1940 гг.)
Лауреат Нобелевской премии за открытие электрона, предложил одну из первых атомных моделей, исследовал катодные и рентгеновские лучи, изучал прохождение электрического тока через разряженные газы, разработал принцип действия масс-спектрометра.
21
Слайд 22
Эрнест Резерфорд
Лауреат Нобелевской премии по химии за исследования по превращению элементов и химии радиоактивных веществ. Установил строение атома, доказал существование в нем ядра, первым осуществил искусственное превращение ядер, открыл протон.
(1871 – 1937)
22
Слайд 23
Массовое число – A
Общее число нуклонов в ядре называется массовым числом, оно равно массе ядра атома, выраженной в атомных единицах и округленной до целых чисел.
A = 108
A = 197
23
Слайд 24
Зарядовое число – Z
Число протонов в ядре называется зарядовым числом, оно равно порядковому номеру в Периодической системе Д. И. Менделеева.
Z = 47
Z = 79
24
Слайд 25
1. Радиоактивность
Кем было сделано открытие данного явления?
Как проводился опыт?
Какие выводы были сделаны в ходе наблюдения?
Слайд 26
2. Демокрит
Кто, наряду с Демокритом высказывал предположение о дискретном строении вещества?
Как были названы частицы?
Что означает название «атом?»
Слайд 27
3. Резерфорд
Как проводился опыт по определению состава радиоактивного излучения?
Как были названы частицы, входившие в состав радиоактивного излучения?
Что представляют собой эти частицы?
Слайд 28
4. Томсон
Что представляет собой атом согласно модели, предложенной Томсоном?
Какие явления и как описывала эта модель?
 Строение атома
Строение атома Строение атома. Химия 7 класс тренажёр
Строение атома. Химия 7 класс тренажёр Физика 9 класс «Строение атома»
Физика 9 класс «Строение атома» Тема урока. Делимость электрического заряда. Строение атома. Электрон. Объяснение электрических явлений
Тема урока. Делимость электрического заряда. Строение атома. Электрон. Объяснение электрических явлений Строение атома (лекция)
Строение атома (лекция) Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов
Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов Строение ароматических углеводородов - Ароматическая связь
Строение ароматических углеводородов - Ароматическая связь