Презентация - Строение атома (лекция)
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 81%
- Слайдов: 86
- Просмотров: 3897
- Скачиваний: 937
- Размер: 1.78 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Строение атома
Строение атома Строение атома. Химия 7 класс тренажёр
Строение атома. Химия 7 класс тренажёр Строение половой системы сельскохозяйственных животных" Лекции
Строение половой системы сельскохозяйственных животных" Лекции Физика 9 класс «Строение атома»
Физика 9 класс «Строение атома» Тема урока. Делимость электрического заряда. Строение атома. Электрон. Объяснение электрических явлений
Тема урока. Делимость электрического заряда. Строение атома. Электрон. Объяснение электрических явлений Строение атома
Строение атома Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов
Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 11 Строение атома
Слайд 2

Атом – это мельчайшая частица химического элемента, сохраняющая его химические свойства.
Слайд 3

Атом – это электронейтральная микросистема, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Слайд 4

Учение об атоме прошло длительный путь развития. Основные этапы атомистики : 1. Натурфилософский этап - период формирования концепции об атомном строении материи, не подтвержденной экспериментом (V век до н.э. -16 век н.э.)
Слайд 5

Из ничего ничего не бывает: ничто из того что есть, не может быть уничтожено. Всякое изменение есть только соединение и разделение частей.
2. Ничто не происходит случайно, но все происходит по некоторой причине и необходимости.
3. Ничего не существует, кроме атомов и пустого пространства. 4. Атомы невидимы глазом, бесконечны в числе и бесконечно различны по форме.
Демокрит 460 - 370 г.г до н.э.
Слайд 6

2. Этап формирования гипотезы об атоме как мельчайшей частице химического элемента (XVIII-XIX в.в.)
Слайд 7

М. В. Ломоносов 1711 - 1765 Один из создателей закона сохранения массы веществ, автор атомно-корпускулярного учения и кинетической теории теплоты. Он обосновал необходимость привлечения физики для объяснения химических реакций
Слайд 8

Английский физик и химик, автор закона кратных отношений. Он ввел понятие "атомный вес", первым определил атомные веса (массы) ряда элементов. Открыл газовые законы, названные его именем.
Джон Дальтон 1766 -1844
Слайд 9

3. Этап создания физических моделей , отражающих сложность строения атома и позволяющих описать его свойства ( начало XX в.)
Слайд 10

Английский физик, научные исследования которого посвящены атомной и ядерной физике. Заложил основы современного учения о радиоактивности и теории строения атома.
РЕЗЕРФОРД Эрнест
(1871 - 1937)
Слайд 11

Нильс Бор 1885 — 1962 Датский физик, создатель квантовой теории водорода, автор моделей атомов других элементов.
Слайд 12

Современный этап атомистики называется квантово-механическим.
Слайд 13

Квантовая механика – это раздел физики, изучающий движение элементарных частиц.
Слайд 14

П Л А Н 11 .1 Строение ядра. Изотопы. 11 .2 Квантово-механическая модель электронной оболочки атома. 11 .3 Физико-химические характеристики атомов.
Слайд 15

11.1 Ядро атома – это положительно заряженная частица, состоящая из протонов, нейтронов и некоторых других элементарных частиц.
Слайд 16

В ядре сосредоточено 99,95 % массы атома
Слайд 17

Между элементарными частицами действуют особые ядерные силы протяжения, значительно превосходящие силы электростатического отталкивания.
Слайд 18

Протон ( p ): А r 1, относительный заряд 1 Нейтрон (n), А r 1, электронейтральная частица
Слайд 19

Фундаментальной характеристикой атома является заряд его ядра , равный числу протонов и совпадающий с порядковым номером элемента в ПС.
Слайд 20

Совокупность (вид) атомов с одинаковым зарядом ядра называется химическим элементом. В природе найдены элементы с номерами 1-92.
Слайд 21

Изотопы – это атомы одного химического элемента, содержащие одинаковое количество протонов и разное количество нейтронов в ядре.
Слайд 22

Каждый химический элемент представляет собой смесь изотопов .
Слайд 23

Химический элемент водород состоит из трех изотопов: Число р Число n Протий Н 1 0 Дейтерий Д 1 1 Тритий Т 1 2
Слайд 24
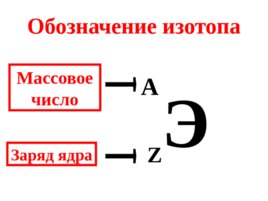
Обозначение изотопа Э A Z Массовое число Заряд ядра
Слайд 25

Изотопы одного химического элемента могут быть как стабильными , так и радиоактивными .
Слайд 26

Радиоактивные изотопы содержат ядра, самопроизвольно разрушающиеся с выделением частиц и энергии.
Слайд 27

Стабильность ядра определяется его нейтронно-протонным отношением .
Слайд 28
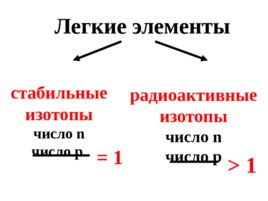
Легкие элементы стабильные изотопы число n число р радиоактивные изотопы число n число р 1 1
Слайд 29
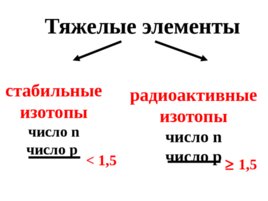
Тяжелые элементы стабильные изотопы число n число р радиоактивные изотопы число n число р 1 ,5 1,5
Слайд 30

Изотопы Cs 133–55 Cs - 133 1,41 55 стабильный изотоп 137–55 Cs - 137 1,5 55 радиоактивный изотоп
Слайд 31

Попадая в организм, радионуклиды нарушают протекание важнейших биохимических процессов, снижают иммунитет, обрекают организм на болезни.
Слайд 32

Организм защищает себя от воздействия радиации, избирательно поглощая элементы из окружающей среды. Стабильные изотопы имеют приоритет перед радиоактивными.
Слайд 33

Стабильные изотопы блокируют накопление радиоактивных изотопов в живых организмах .
Слайд 34
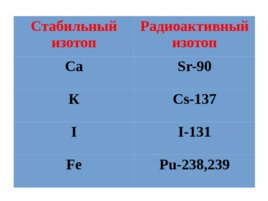
Стабильный изотоп Радиоактивный изотоп Са Sr-90 К Cs-137 I I-131 Fe P u -238,239
Слайд 35

: Если блокирующую дозу стабильного изотопа йода, равную 100 мг, принять не позднее чем через 2 часа после попадания I-131, то поглощение радиойода в щитовидной железе снизится на 90%.
Слайд 36

Радиоизотопы применяются в медицине Для диагностики некоторых заболеваний, Для лечения всех форм онкологических заболеваний, Для патофизиологических исследований .
Слайд 37

11.2 Протекание химических реакций сопровождается изменением в электронной оболочке атома.
Слайд 38

1 Электрон (ē) А r 2000 Относительный заряд -1 Открыт Дж. Томсоном в 1897 г.
Слайд 39

Главным постулатом квантовой механики является постулат о невозможности точного определения местоположения электрона в атоме (принцип неопределенности Гейзенберга).
Слайд 40

Квантово-механический метод с большой точностью позволяет рассчитать вероятность пребывания электрона в околоядерном пространстве .
Слайд 41

Атомная орбиталь (АО) – это область околоядерного пространства, в которой вероятность обнаружения электрона составляет не мене 90%.
Слайд 42

АО отличаются по форме, энергии и удаленности от ядра.
Слайд 43

Математическим описанием орбитали является волновая функция ψ.
Слайд 44

Физический смысл волновой функции заключается в том, что произведение ψ 2 d V равно вероятности нахождения электрона в элементарном объеме d V .
Слайд 45
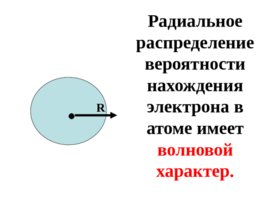
R . Радиальное распределение вероятности нахождения электрона в атоме имеет волновой характер.
Слайд 46
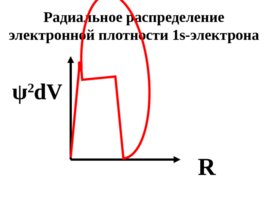
ψ 2 d V R Радиальное распределение электронной плотности 1s- электрона
Слайд 47
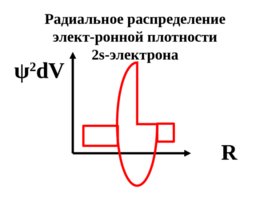
Радиальное распределение элект-ронной плотности 2 s- электрона R ψ 2 d V
Слайд 48

Это дает основание считать электрон одновременно и частицей и волной .
Слайд 49

Энергетическое состояние электрона в атоме описывается при помощи набора из четырех квантовых чисел.
Слайд 50

Квантовые числа 1) главное квантовое число (n) 1,2,3,4... определят общий запас энергии орбитали и ее удаленность от ядра.
Слайд 51

Орбитали с одинаковым значением n образуют энергетический уровень или электронный слой.
Слайд 52
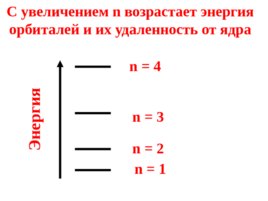
n 1 n 2 n 3 n 4 Энергия С увеличением n возрастает энергия орбиталей и их удаленность от ядра
Слайд 53

2) Орбитальное (побоч - ное) квантовое число ℓ 0, 1, 2, 3....(n – 1) характеризует число подуровней на энергетическом уровне и форму АО.
Слайд 54

Орбитали с одинаковым значением n , но разными значениями ℓ образуют подуровни данного энергетического уровня: ℓ 0 1 2 3 4 Название подуровня s p d f g
Слайд 55

Если n 1, то ℓ 0 Данное орбитальное число соответствует s – подуровню, на котором располагается s- орбиталь, имеющая сферическую симметрию .
Слайд 56

s- Орбиталь
Слайд 57

Если n 2, то ℓ 0, 1 . ℓ 1 соответствует p – подуровню, на котором располагаются p – орбитали, имеющие форму объемной восьмерки.
Слайд 58

p- Орбиталь
Слайд 59

Если n 3, то ℓ 0, 1, 2 ℓ 2 соответствует d -подуровню , на котором располагаются d – орбитали.
Слайд 60

d- Орбитали
Слайд 61

Если n 4, то ℓ 0, 1, 2, 3 . ℓ 3 соответствует f- подуровню , на котором располагаются f -орбитали.
Слайд 62

3) Магнитное квантовое число m ℓ – ℓ ... O... ℓ характеризует ориентацию АО в пространстве, а так же количество АО на подуровне.
Слайд 63

Для s- подуровня ( ℓ 0) m s 0, следовательно на s- подуровне находится только одна s- орбиталь
Слайд 64
Графическое изображение AO
Слайд 65

Для р-подуровня ( ℓ 1) m p –1, 0, 1 , следовательно на р-подуровне находятся три орбитали: p х , р у , р z
Слайд 66
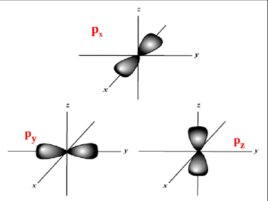
P x -AO p x p y p z
Слайд 67
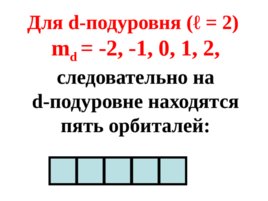
Для d- подуровня ( ℓ 2) m d - 2 , - 1, 0, 1, 2, следовательно на d- подуровне находятся пять орбиталей:
Слайд 68
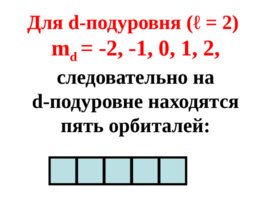
Для d- подуровня ( ℓ 2) m d - 2 , - 1, 0, 1, 2, следовательно на d- подуровне находятся пять орбиталей:
Слайд 69

Для f- подуровня ( ℓ 3) m f -3 , - 2 ,- 1, 0,1, 2, 3 следовательно на f- подуровне находятся семь орбиталей:
Слайд 70
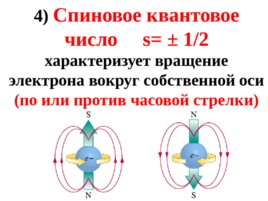
4) Спиновое квантовое число s 1/2 характеризует вращение электрона вокруг собственной оси ( по или против часовой стрелки)
Слайд 71

Распределение электронов в многоэлектронном атоме 1. Принцип минимальной энергии: электрон занимает орбиталь с наименьшим запасом энергии.
Слайд 72

2. Принцип Паули : в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Слайд 73

Следствие : на одной орбитали располагается не более двух электронов с антипараллельными спинами.
Слайд 74
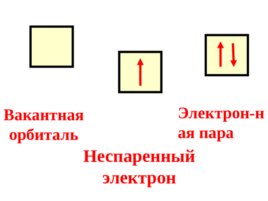
Вакантная орбиталь Неспаренный электрон Электрон-ная пара
Слайд 75

3. Правило Гунда : электроны на подуровне располагаются так, чтобы их суммарный спин был максимальным.
Слайд 76
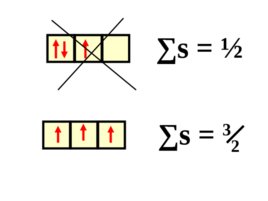
s s 3 2
Слайд 77

4. Правила Клечковского : АО заполняются электронами в порядке последовательного увеличения суммы (n ℓ ) (1-е правило) .
Слайд 78

При одинаковых значениях этой суммы – в порядке последовательного увеличения главного квантового числа (2-е правило).
Слайд 79

11.3 Физико-химические характеристики атомов 1) заряд ядра и относительная атомная масса являются фундаментальными характеристиками атома;
Слайд 80

2) Орбитальные атомные радиусы (R, нм) - теоретически рассчитанное расстояние от ядра до максимума электронной плотности внешней орбитали.
Слайд 81

3) Энергия ионизации (I, к Дж/моль или э В) – минимальная энергия, достаточная для удаления электрона из атома: Э – ē Э
Слайд 82

4) Сродство к электрону ( F, к Дж/моль или э В)- это энергетический эффект присоединения электрона к атому : Э ē Э
Слайд 83

5) Электроотрицательность ЭО (I F ) – это способность атома притягивать к себе электроны при образовании химической связи.
Слайд 84

Как правило, для сравнения способности атомов притягивать к себе электроны пользуются шкалой относительной электроотрицательности, предложенной Л. Полингом в 1932.
Слайд 85

Лайнус Полинг (1901-1994)
Слайд 86

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
