Презентация - Катализ и катализаторы
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 96%
- Слайдов: 68
- Просмотров: 4837
- Скачиваний: 1013
- Размер: 0.13 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Ферменты – биологические катализаторы
Ферменты – биологические катализаторы Городские квесты как катализатор развития местного локального сообщества
Городские квесты как катализатор развития местного локального сообщества Каталитическая активность ферментов
Каталитическая активность ферментов
 Общая химия - раздел химической науки, изучающий основные законы, описывающие химические процессы, протекающие в живой и неживой природе
Общая химия - раздел химической науки, изучающий основные законы, описывающие химические процессы, протекающие в живой и неживой природе
 Физико-химические свойства растворов
Физико-химические свойства растворов
 Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика
 Человек таков, каково его представление о счастье
Человек таков, каково его представление о счастье
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 10 Катализ и катализаторы
Слайд 2

1 0 .1 Катализ и катализаторы . 1 0 .2 Кинетика ферментативных реакций. План
Слайд 3

10.1 Катализ – это явление изменения скорости реакции под влиянием веществ, называемых катализаторами .
Слайд 4

Катализаторы – это вещества, изменяющие скорость химической реакции, но не изменяющиеся в ходе процесса ни качественно, ни количественно. Они не входят в состав продуктов реакции.
Слайд 5

Небольшие количества катализаторов способны существенно изменить скорость взаимодействия большого количества реагирующих веществ.
Слайд 6
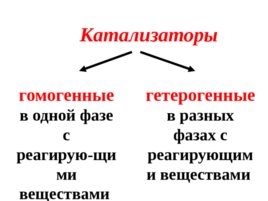
Катализаторы гомогенные в одной фазе с реагирую - щими веществами гетерогенные в разных фазах с реагирующими веществами
Слайд 7

Пример гетерогенного катализа
Слайд 8

Пример гомогенного катализа
Слайд 9
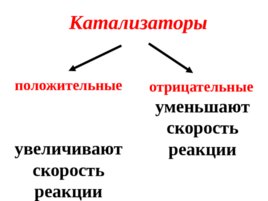
Катализаторы положительные увеличивают скорость реакции отрицательные уменьшают скорость реакции
Слайд 10

Вещества, усиливающие действие катализаторов, называются промоторами, а ослабляющие - каталитическими ядами.
Слайд 11

Ингибаторы – вещества, уменьшающие скорость реакции, но расходующиеся при этом сами.
Слайд 12

С точки зрения теории активного комплекса механизм действия катализаторов в том, что они изменяют высоту энергетического барьера химической реакции.
Слайд 13

Без катализатора: А В А... В АВ В присутствии катали-затора: А В К А... К... В АВ К
Слайд 14
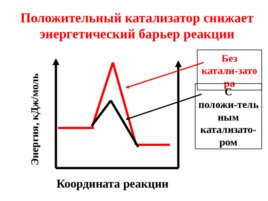
Координата реакции Положительный катализатор снижает энергетический барьер реакции Энергия, к Дж/моль Без катали-затора С положи-тельным катализато-ром
Слайд 15

Под воздействием положительного катализатора в реакционной смеси возрастает доля активных молекул при данной температуре. Скорость реакции увеличивается.
Слайд 16
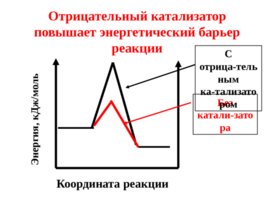
Координата реакции Отрицательный катализатор повышает энергетический барьер реакции Энергия, к Дж/моль Без катали-затора С отрица-тельным ка-тализатором
Слайд 17

Под воздействием отрицательного катализатора в реакционной смеси снижается доля активных молекул при данной температуре. Скорость реакции уменьшается.
Слайд 18
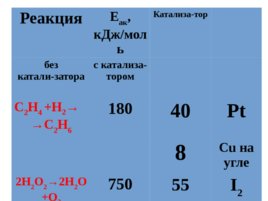
Реакция Е ак , к Дж/моль Катализа-тор без катали-затора с катализа - тором С 2 Н 4 H 2 С 2 Н 6 180 40 Pt 8 Cu на угле 2H 2 O 2 2H 2 O O 2 750 55 I 2 20 каталаза
Слайд 19

Частным случаем катализа является автокатализ : катализатором служит один из продуктов реакции.
Слайд 20

Пример автокаталитической реакции : 2 KMn O 4 5 H 2 C 2 O 4 3 H 2 SO 4 2 Mn SO 4 10 CO 2 K 2 SO 4 8 H 2 O Катализатор: Mn 2
Слайд 21

Кинетическая кривая автокаталитической реакции время Концентрация, моль/л
Слайд 22

Катализаторы широко применяются в химической промышленности. В США рынок катализаторов составляет 2 млрд. $.
Слайд 23

Однако некоторые каталитические процессы в природе оказываются разрушительными для окружающей среды.
Слайд 24

Разрушение озонового слоя Земли – пример гомогенного катализа, протекающего в атмосфере под воздействием фреонов.
Слайд 25
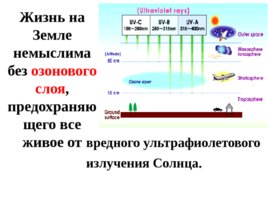
Жизнь на Земле немыслима без озонового слоя , предохраняющего все живое от вредного ультрафиолетового излучения Солнца.
Слайд 26

Исчезновение озоносферы привело бы к непредсказуемым последствиям - вспышке рака кожи, уничтожению планктона в океане, мутациям растительного и животного мира.
Слайд 27
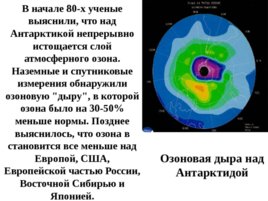
Озоновая дыра над Антарктидой В начале 80-х ученые выяснили, что над Антарктикой непрерывно истощается слой атмосферного озона. Наземные и спутниковые измерения обнаружили озоновую "дыру", в которой озона было на 30-50% меньше нормы. Позднее выяснилось, что озона в становится все меньше над Европой, США, Европейской частью России, Восточной Сибирью и Японией.
Слайд 28

Фреоны – это фторо-хлороуглеводороды ( С F 2 Cl 2 ) , применяемые как хладагенты. При обычных условиях они отличаются высокой устойчивостью к разложению.
Слайд 29

В атмосфере происходит разложение фреонов под воздействием ультрафиолетового излучения солнца: CF 2 Cl 2 CF 2 Cl Cl Cl - катализатор разложения озона
Слайд 30

Без катализатора процесс протекает по схеме: O 3 O 2 O 2 E ак 17,1 к Дж / моль
Слайд 31

В присутствии катализатора : O 3 Cl Cl O O 2 E ак 2,1 к Дж / моль Cl O O Cl O 2 E ак 0,4 к Дж / моль O 3 O 2 O 2 Cl
Слайд 32
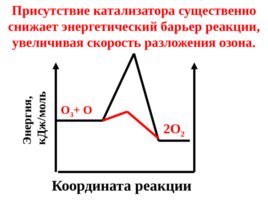
Координата реакции Энергия, к Дж / моль О 3 О 2О 2 Присутствие катализатора существенно снижает энергетический барьер реакции, увеличивая скорость разложения озона.
Слайд 33

1987 году в Монреале состоялась Международная конференция, посвященная угрозе озоновому слою. Промышленно развитые страны договорились о сокращении производства хлорированных и фторированных углеводородов.
Слайд 34

К 1992 году замена этих веществ на безопасные проходила так успешно, что было принято решение о полном их уничтожении к 1996 году. Сегодня ученые верят, что лет через пятьдесят озоновый слой восстановится полностью.
Слайд 35

1 0 .2 Практически все биохимические реакции являются ферментативными.
Слайд 36

Ферменты (биокатализаторы) – это вещества белковой природы, активированные катионами металлов.
Слайд 37

Известно около 2000 различных ферментов, 150 из них выделены, причем некоторые используются в качестве лекарственных препаратов.
Слайд 38

Трипсин и химотрипсин – лечение бронхитов и пневмонии; пепсин – лечение гастрита; плазмин – лечение инфаркта; панкреатин – лечение поджелудочной железы.
Слайд 39

Ферменты отличаются от обычных катализаторов: а) более высокой каталитической активностью; б) высокой специфичностью, т.е. избирательностью действия.
Слайд 40
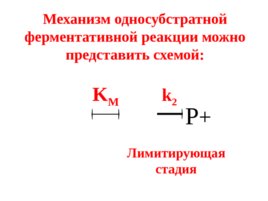
Механизм односубстратной ферментативной реакции можно представить схемой: P K M k 2 Лимитирующая стадия
Слайд 41

Е – фермент, S – субстрат, ЕS – фермент- субстратный комплекс, Р – продукт
Слайд 42

Характеристикой первой стадии ферментативной реакции является К М – константа Михаэлиса. К М является величиной, обратной константе равновесия.
Слайд 43
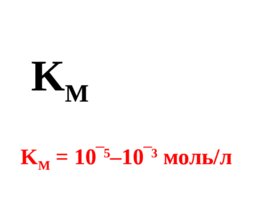
K M K M 10 5 –10 3 моль/л
Слайд 44

К М характеризует устойчивость фермент-субстратного комплекса (ES). Чем меньше К М , тем устойчивее комплекс .
Слайд 45

Кинетическое уравнение: k 2 ES , (1) где k 2 – константа скорости, называемая числом оборотов или молекулярной активностью фермента .
Слайд 46

k 2 равна числу молекул субстрата, претерпевающих превращения под воздействием одной молекулы фермента за 1 минуту при 25 0 С 1 10 4 k 2 6 10 6 мин 1
Слайд 47

Для уреазы , ускоряющей гидролиз мочевины: k 2 1,85 10 6 мин 1 Для аденозинтрифосфатазы , ускоряющей гидролиз АТФ: k 2 6,24 10 6 мин 1 Для каталазы , ускоряющей разложение Н 2 О 2 : k 2 5 10 6 мин 1
Слайд 48

Существенным недостатком уравнения (1) является невозможность экспериментального определения ES .
Слайд 49

Выразив ES через другие величины, получаем кинетическое уравнение ферментативных реакций, называемое уравнением Михаэлиса-Ментен (1913 )
Слайд 50

E общ S K M S k 2 Уравнение Михаэлиса-Ментен
Слайд 51

Произведение k 2 E общ является величиной постоянной, которую обозначают max (максимальная скорость).
Слайд 52

Соответственно: max S K M S
Слайд 53
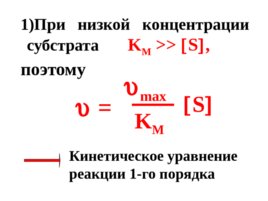
При низкой концентрации субстрата K M S , поэтому max K M S Кинетическое уравнение реакции 1-го порядка
Слайд 54

2) При высокой концентрации субстрата К м поэтому Кинетическое уравнение реакции 0 -го порядка max
Слайд 55
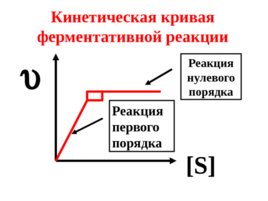
Кинетическая кривая ферментативной реакции S Реакция нулевого порядка Реакция первого порядка
Слайд 56

3) Если S К М , то max 2 что позволяет графически определять К м ,
Слайд 57
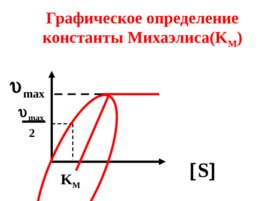
S max 2 max K M Графическое определение константы Михаэлиса( K M )
Слайд 58

Ферменты, как правило, катализируют реакции с участием двух или нескольких субстратов. Для изображения двухсубстратных реакций используют схемы, в которых обозначены промежуточные стадии, а также стадии ввода субстратов и вывода продуктов.
Слайд 59

A B P Q E EA EQ E EAB EPQ Последовательный механизм ферментативных реакций
Слайд 60
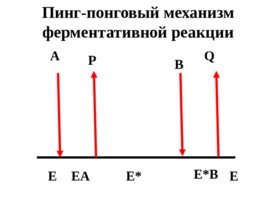
A B P Q E EA E B E E Пинг-понговый механизм ферментативной реакции
Слайд 61

На активность ферментов оказывают влияние: а) температура, б) кислотность среды, в) наличие ингибиторов
Слайд 62
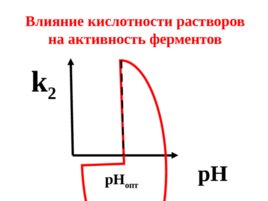
p H р Н опт Влияние кислотности растворов на активность ферментов k 2
Слайд 63

Для большинства ферментов оптимальные значения р Н совпадают с физиологическими значениями (7,3-7,4).
Слайд 64

Однако существуют ферменты, для нормального функционирования которых нужна сильнокислая (пепсин – 1,5-2,5) или достаточно щелочная среда (аргиназа – 9,5-9,9) .
Слайд 65

Ингибиторы ферментов – это вещества, занимающие часть активных центров молекул фермента, в результате чего скорость ферментативной реакции уменьшается.
Слайд 66
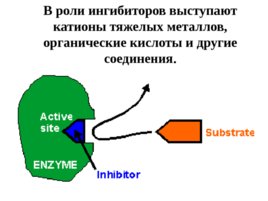
В роли ингибиторов выступают катионы тяжелых металлов, органические кислоты и другие соединения.
Слайд 67

"Ключ к познанию ферментов лежит в изучении скоростей реакций". Дж. Холдейн
Слайд 68

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
