Презентация - Второй закон термодинамики. Биоэнергетика
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 97%
- Слайдов: 93
- Просмотров: 5867
- Скачиваний: 2556
- Размер: 0.27 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Второй закон Ньютона
Второй закон Ньютона Решение задач на законы термодинамики
Решение задач на законы термодинамики Первый закон термодинамики
Первый закон термодинамики Импульс тела (примеры на закон сохранения импульса)
Импульс тела (примеры на закон сохранения импульса) Закономерности и случайности в жизни народов
Закономерности и случайности в жизни народов Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы По наличию второстепенных членов. Нераспространенные. Распространенные
По наличию второстепенных членов. Нераспространенные. Распространенные
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 2
Второй закон термодинамики. Биоэнергетика .
Слайд 2

План 2.1 Второй закон термодинамики. Энтропия 2.2 Свободная энергия Гиббса . 2.3 Биоэнергетика
Слайд 3

2.1 Химические реакции и физико-химические процессы можно разделить на две группы: самопроизвольные (спонтанные) несамопроизвольные (неспонтанные)
Слайд 4

Самопроизвольные процессы протекают без сообщения системе дополнительной энергии из окружающей среды.
Слайд 5

Самопроизвольно протекают процессы Растворения Диффузии Осмоса Расширения газа в пустоту
Слайд 6

Пределом протекания самопроизвольных процессов является состояние термодинамического равновесия .
Слайд 7

Термодинамическое равновесие – это такое состояние системы, в котором ее термодинамические параметры (T, p, V и др.) не изменяются во времени и имеют одинаковое значение во всех точках объема системы.
Слайд 8

Система, находящаяся в равновесии, не способна выполнять работу .
Слайд 9

Термодинамическое равновесие достигается только в закрытых и изолированных системах. Оно не достижимо для открытых систем из-за постоянно изменяющихся внешних условий.
Слайд 10

Для открытых систем аналогом равновесного является стационарное состояние, обусловленное сбалансированностью потоков энергии и вещества в систему и из системы.
Слайд 11

Стационарное состояние характеризуется длительным постоянством термодинамических параметров системы и одновременной способностью совершать полезную работу.
Слайд 12

Для протекания несамопроизвольных процессов необходимо сообщить системе дополнительную энергию. Например, фотосинтез, протекающий под воздействием УФ излучения.
Слайд 13

Одним из фундаментальных свойств природы является ее ассиметрия . Ассиметрия природных процессов проявляется в их однонаправленности.
Слайд 14
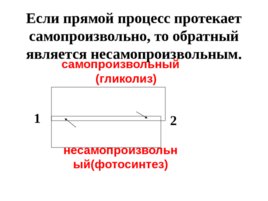
самопроизвольный ( гликолиз )
несамопроизвольный ( фотосинтез ) 1 2 Если прямой процесс протекает самопроизвольно, то обратный является несамопроизвольным.
Слайд 15

Рассмотрение вопросов о характере протекания процессов выполняется в рамках второго закона термодинамики.
Слайд 16

Второй закон термодинамики был сформулирован на основе анализа действия тепловых машин.
Слайд 17

Тепловая машина – это устройство , в котором тепловая энергия превращается в механическую работу.
Слайд 18
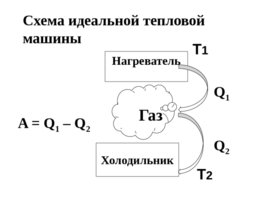
Нагреватель Холодильник T 1 T 2 Схема идеальной тепловой машины
A Q 1 – Q 2 Q 1 Q 2 Газ
Слайд 19

Теоремы Карно : 1) Коэффициент полезного действия тепловой машины, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Слайд 20

2) Коэффициент полезного действия тепловой машины всегда меньше единицы .
Слайд 21

А Q 1 – Q 2 Т 1 – Т 2 к.п.д. , Q 1 Q 1 Т 1 Уравнение Карно Поскольку Т 2 0, (абсолютный нуль не достижим), то к.п.д. 1
Слайд 22

К.п.д. даже самых современных тепловых машин невысок: для тепловозов – 20 %, двигателей внутреннего сгорания – 30 %.
Слайд 23

К.п.д. превращения химической энергии пищи – 25 %, к.п.д. превращения энергии АТФ в работу мышц 50 % , К.п.д. здорового сердца – 43 %.
Слайд 24

Формулировки второго закона: 1) Невозможно полностью превратить теплоту в работу ( У. Кельвин 1851 ).
Слайд 25

2) Невозможен процесс, единственный результат которого состоял бы в переходе энергии от холодного тела к горячему ( Клаузиус, 1865).
Слайд 26

Для математического описания Второго закона термодинамики используется термодинамическая функция состояния, называемая Энтропией (S, Дж/К)
Слайд 27

Термин «Энтропия» был предложен Клаузиусом в 1865. Рудольф Юлиус Эмануэль КЛАУЗИУС
1822–88
Слайд 28

Энтропия (S) – это отношение теплоты, поступающей в систему, к температуре системы : S Q/T
Слайд 29

Энтропия является единственной функцией состояния, имеющей два толкования: Термодинамическое , Статистическое
Слайд 30

Термодинамическое толкование энтропии Энтропия является характеристикой тепловых потерь системы в данном интервале температур .
Слайд 31

Энтропия характеризует ту часть теплоты, которая рассеивается в пространстве, не превращаясь в полезную работу .
Слайд 32

Чем больше энтропия, тем ниже « качество энергии » (меньше к.п.д. процесса)
Слайд 33

Взаимосвязь энтропии, теплоты и температуры описывается неравенством Клаузиуса: ΔS Q Т
Слайд 34

Клаузиус предложил обобщенную формулировку первого и второго законов: « Энергия мира постоянна, его энтропия постоянно увеличивается»
Слайд 35

Статистическое толкование энтропии Статистическое толкование энтропии было предложено Л. Больцманом в 1904 г.
Слайд 36

Статистическая термодинамика рассматривает энергетическое состояние системы, исходя из состояния ее структурных единиц .
Слайд 37

Уравнение Больцмана где k - константа Больцмана R N A k S k ℓ n W
Слайд 38

W - термодинамическая вероятность системы, т.е. число микросостояний, посредством которых реализуется данное макросостояние.
Слайд 39

Микросостояние – это скорость, энергия, импульс движения и другие характеристики каждой отдельно взятой структурной единицы. Чем меньше число микросостояний, тем выше упорядоченность системы .
Слайд 40
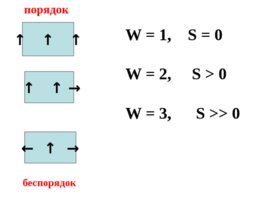
W 1, S 0 W 2, S 0 W 3, S 0 порядок беспорядок
Слайд 41

Энтропия – количественная мера беспорядка в системе. Чем больше энтропия системы, тем больше беспорядок в ней .
Слайд 42
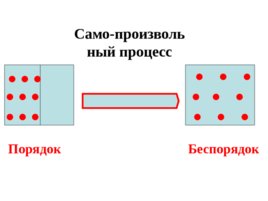
Порядок Беспорядок Само-произвольный процесс
Слайд 43

Самопроизвольные процессы протекают с ростом энтропии. Максимум энтропии достигается в состоянии равновесия (формулировка Л. Больцмана)
Слайд 44

Изменение энтропии открытых стационарных систем было описано И. Пригожиным
Слайд 45

Теорема И. Пригожина (1946): в стационарной термодинамически открытой системе скорость производства энтропии, обусловленного протеканием в ней самопроизвольных процессов, принимает минимальное положительное значение: Δ S i 0 τ
Слайд 46

Теорема И. Пригожина объясняет причину гомеостаза - постоянства внутренний среды организма. Она не применима к описанию процессов, протекающих в организме новорожденных, так как они протекают со значительной скоростью
Слайд 47

Расчет энтропии химической реакции (Δ r S) по следствию из закона Гесса Для условной реакции: а А b В с С d D Δ r S c S (C) d S (D) – a S (A) – b S (B)
Слайд 48

Если Δ r S 0 реакция протекает с увеличением беспорядка; Если Δ r S 0 реакция протекает с уменьшением беспорядка.
Слайд 49

2.2 При протекании химических процессов наблюдаются две противоположные тенденции.
Слайд 50

стремление отдельных частиц соединится в более крупные агрегаты, что приводит к уменьшению запаса внутренней энергии системы: H min;
Слайд 51

стремление агрегатов к разделению на более мелкие частицы, что приводит к увеличению энтропии: S max
Слайд 52

G H - TS Обе тенденции находят свое отражение в термодинамической функции состояния, называемой свободной энергией Гиббса или изобарно-изотермическим потенциалом G: G H - T S
Слайд 53

Дж. У. Гиббс (11. II.1839 - 28. IV.1903) Американский физик и химик, один из основоположников классической термодинамики, профессор в Йельском университете. Он первым применил термодинамические законы для описания биологических систем.
Слайд 54

Физический смысл Свободной энергии Гиббса понятен из совместного рассмотрения первого и второго законов термодинамики.
Слайд 55
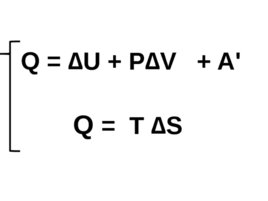
Q U P V A ' Q T S
Слайд 56

Отсюда A ' T S - U - p V T S - ( U p V ), где U p V H
Слайд 57

Следовательно, A ' - ( H - T S), где H - T S G
Слайд 58

A ' - G G имеет смысл полезной работы, выполненной в системе или над системой .
Слайд 59

G – это часть внутренней энергии системы, способная превращаться в полезную работу .
Слайд 60

Знак ΔG ( или –) является критерием возможности протекания самопроизвольных процессов в закрытых системах.
Слайд 61

Самопроизвольный процесс: A 0 G 0 Термодинамическое равновесие : A 0 G 0 Несамопроизвольный процесс: A 0 G 0
Слайд 62

Таким образом, самопроизвольно осуществляются те процессы, протекание которых сопровождается уменьшением свободной энергии Гиббса.
Слайд 63

Характер процесса иногда можно изменять, варьируя термодинамические параметры системы : температуру, давление или концентрацию реагирующих веществ.
Слайд 64

Влияние температуры на характер процесса ΔG ΔН – Т S (–) ( ) Экзотермический Увеличение процесс беспорядка В этом случае ΔG 0, следовательно, самопроизвольный процесс протекает при любой температуре; А)
Слайд 65
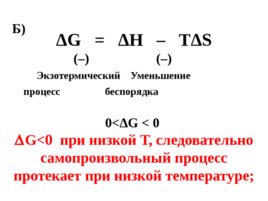
ΔG ΔН – ТΔ S (–) (–) Экзотермический Уменьшение процесс беспорядка 0 ΔG 0 G при низкой Т, следовательно самопроизвольный процесс протекает при низкой температуре; Б)
Слайд 66

ΔG ΔН – ТΔ S ( ) ( ) Эндотермический Увеличение процесс беспорядка 0 ΔG 0 G при высокой Т, следовательно самопроизвольный процесс протекает при высокой температуре; В)
Слайд 67

ΔG ΔН – ТΔ S ( ) (–) Эндотермический Уменьшение процесс беспорядка ΔG 0 при всех температурах, следовательно процесс является несамопроизвольным; он термодинамически запрещен. Г)
Слайд 68

Рассчитав ΔG, можно определить: характер процесса (само - или несамопроизвольный); величину полезной работы, совершаемой при протекании самопроизвольного процесса.
Слайд 69

Способы расчета G 1. Свободную энергию химической реакции можно рассчитать по уравнению: Δ r G Δ r H – ТΔ r S, где ТΔ r S – энтропийный фактор химической реакции
Слайд 70

2 . Свободную энергию химической реакции можно рассчитать на основе закона Гесса: Δ r G с Δ f G (C) d Δ f G (D) - - a Δ f G (A) - b Δ f G (B) где f G - свободная энергия образования сложного вещества из простых веществ, k Дж / моль
Слайд 71

3 . Расчет G переноса вещества из одной фазы в другую: ΔG – ν RT l n где ν – количество переносимого вещества, моль; R – универсальная газовая постоянная, 8,31 Дж/моль К; С М 1 и C М 2 – концентрации вещества в различных фазах, моль/л (С М 1 C М 2 ) C М 2 C М 1
Слайд 72
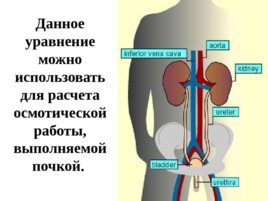
Данное уравнение можно использовать для расчета осмотической работы, выполняемой почкой .
Слайд 73

2 .3 Биоэнергетика – это раздел термодинамики, изучающий превращения энергии, теплоты и работы в живых системах.
Слайд 74

Человек – это открытая стационарная система, главным источником энергии для которой служит химическая энергия пищи (99 %).
Слайд 75

Энергетические затраты человека обеспечиваются за счет: углеводов на 55-60%, жиров на 20-25%, белков на 15-20%.
Слайд 76

Получаемая энергия расходуется на: Совершение работы внутренних органов , связанной с дыханием, кровообращением, перемещением метаболитов, секрецией соков и т.д., Совершение внешней работы , связанной со всеми перемещениями человека и его трудовой деятельностью, Нагревание вдыхаемого воздуха, потребляемой воды и пищи.
Слайд 77

Коэффициент полезного действия превращения химической энергии пищи в организме человека составляет 25 %.
Слайд 78

Таким образом, энтропийные потери организма составляют 75%. Если сфокусировать теплоту, излучаемую телом человека за сутки, то можно вскипятить 20 л воды.
Слайд 79

Биохимическими называются химические реакции, протекающие в биосистемах ( in vivo ). БИОХИМИЧЕСКИЕ РЕАКЦИИ Экзергонические (самопроизвольные) Δ r G 0 Эндергонические (несамопроизвольные) Δ r G 0
Слайд 80

Окисление углеводов и жиров в организме протекает самопроизвольно и сопровождается выделением большого количества энергии: C 6 H 12 O 6 6 O 2 6 CO 2 6 H 2 O , G - 2870 к Дж C 15 H 31 COOH 23 O 2 16 CO 2 Пальмитиновая к-та 16 H 2 O, G - 9790 к Дж
Слайд 81

Часть энергии, выделяющаяся при окислении компонентов пищи, накапливается в макроэргических соединениях , таких как АТФ, АДФ, ацетилкофермент A и др. АДФ H 3 PO 4 АТФ H 2 O , G 30 ,6 к Дж
Слайд 82

При физиологических условиях синтез АТФ протекает совместно с окислением глюкозы до СО 2 и воды. Энергия, выделяющаяся при окислении одной молекулы глюкозы, достаточна для синтеза 36 молекул АТФ из АДФ и фосфата.
Слайд 83

Такие реакции называются сопряженными . Принцип энергетического сопряжения состоит в следующим: эндергонические реакции протекают за счет энергии экзергонических реакций .
Слайд 84

Как правило, сопряженные реакции катализируются общим ферментом .
Слайд 85

Схема сопряженной реакции A B C D, G 1 L M P Q , G 2 0 G общ G 1 G 2 Обе реакции протекают как единый самопроизвольный процесс
Слайд 86

Пример энергетического сопряжения : C 6 H 12 O 6 6 O 2 6 CO 2 6 H 2 O, G - 2870 к Дж 36 (A ДФ H 3 PO 4 ) 36 (AT Ф H 2 O), G 1100 к Дж -------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- G общ. - 2870 1100 - 1770 к Дж
Слайд 87

Приведенные данные позволяют рассчитать к.п.д. клетки: Выделилось 2870 к Дж, Аккумулировано 1100 к Дж , Энтропийные потери 1770 к Дж к.п.д 1100/2870 0.38 or 38%
Слайд 88

Таким образом, клетка аккумулирует лишь 38% химической энергии глюкозы, а оставшиеся 62% рассеивается в пространстве как теплота .
Слайд 89

В современной медицине широко применяются методы биоэнергетической диагностики и терапии. К биоэнергетическим методам лечения относятся: Иглотерапия
Слайд 90
Гирудотерапия (лечение медицинскими пиявками)
Слайд 91

Массаж
Слайд 92

Упражнения по системе Йоги и др.
Слайд 93

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
