Презентация - Физико-химические свойства растворов
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 85%
- Слайдов: 76
- Просмотров: 5702
- Скачиваний: 2517
- Размер: 0.34 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Физико-химические свойства аммиака
Физико-химические свойства аммиака Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Химические свойства металлов - Электрохимический ряд напряжения металлов
Химические свойства металлов - Электрохимический ряд напряжения металлов Общие химические свойства металлов
Общие химические свойства металлов Химические свойства кислот
Химические свойства кислот Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Текстильные материалы из химических волокон - Свойства химических волокон
Текстильные материалы из химических волокон - Свойства химических волокон
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 4 Физико-химические свойства растворов
Слайд 2

План 4 .1 Растворы и их классификация. 4 .2 Термодинамика растворения. 4 .3 Растворимость газов, жидкостей и твердых веществ в воде.
Слайд 3

4 .1 Растворы - это гомогенные устойчивые системы переменного состава, состоящие минимум из двух компонентов: растворителя и растворенного вещества .
Слайд 4

С точки зрения термодинамики все компоненты раствора равноценны; растворителем принято считать компонент, агрегатное состояние которого совпадает с агрегатным состоянием раствора.
Слайд 5

Если нельзя определить растворитель по этому признаку, то им считается компонент с большей массой .
Слайд 6

а) по агрегатному состоянию Газообразные :воздух, смесь О 2 и СО 2 (карбоген) для активации дыхательного центра; Жидкие : биологические жидкости человека; Твердые : сплавы металлов, растворы H 2 в платиновых металлах Классификация растворов
Слайд 7

б) по размеру частиц растворенного вещества Истинные (молекулярные) 10 -9 м, Коллоидные 10 -9 10 -7 м (кровь) Грубодисперсные 10 -7 м где - диаметр частицы растворенного вещества , м
Слайд 8

1) жизнь зародилась в мировом океане; современные животные и человек унаследовали от океанических предков неорганический состав крови, сходный с составом морской воды Растворы играют важнейшую роль в биосфере:
Слайд 9

Слайд 10

2) усвоение питательных веществ и лекарственных препаратов происходит в растворенном виде; 3) в растворах протекают биохимические реакции. Важнейшим биогенным растворителем является вода.
Слайд 11

Вода - самое распространенное на земле вещество. Общий объем воды в биосфере 1,5 10 9 км 3. В живых организмах - 2,3 10 3 км 3 . Считают, что большая часть воды имеет биогенное происхождение, т.е. проходит через метаболические превращения организмов. Суточное потребление воды 2л.
Слайд 12

Содержание воды в организме : а)новорожденного 80%; б) мужчины 60%; в) женщины 55%.
Слайд 13

Содержание воды в органах и тканях человека: а) в печени 96% б) в легких 86% в) в крови и почках 83% г) в тканях мозга и мышечной ткани 75% д)в костях 22%.
Слайд 14

Вода in vivo делится на два бассейна: внеклеточная жидкость а) интерстициальная жидкость(окружает клетки), б) внутрисосудистая (плазма крови) в) трансцеллюлярная жидкость (в полых формах ЖКТ) внутриклеточная
Слайд 15

Потеря 2/3 объема внеклеточной жидкости смертельно опасна. Избыток воды также опасен для здоровья: отеки, водянки, набухание клеток.
Слайд 16

Вода, благодаря своим уникальным физико-химическим свойствам, выполняет многочисленные функции в организме человека
Слайд 17
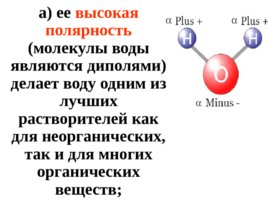
а) ее высокая полярность (молекулы воды являются диполями) делает воду одним из лучших растворителей как для неорганических, так и для многих органических веществ;
Слайд 18

б) ее высокая теплоемкость обеспечивает температурный гомеостаз организма; в) большая теплота испарения воды защищает тело человека от перегрева;
Слайд 19

г)способность воды диссоциировать на ионы позволяет ей участвовать в кислотно-основном равновесии; д) вода является субстратом многих биохимических ре-акций (гидролиз, гидратация);
Слайд 20

е) вода влияет на активность ферментов , регулируя скорость биохимических реакций.
Слайд 21

Растворение - это самопроизвольный обратимый физико-химический процесс, включающий три основные стадии. 4 .2 Термодинамика растворения
Слайд 22

Стадия атомизации- разрушение кристаллической решетки растворяемого о вещества; процесс эндотермический ( ат Н О);
Слайд 23

2) стадия сольватации (гидратации) - образование сольватных (гидратных) оболочек вокруг частиц растворенного вещества; процесс экзотермический, ( сол Н
Слайд 24
Слайд 25

3) стадия диффузии - равномерное распределение растворенного вещества по всему объему раствора, ( диф Н О).
Слайд 26

Таким образом, теплота растворения ( р Н ) является величиной интегральной: p H ат Н сол Н диф Н p H - тепловой эффект растворения 1 моль вещества в бесконечно большом объеме растворителя.
Слайд 27

При растворении большинства твердых веществ p H 0 , т.к. теплота, поглощаемая на стадии атомизации не компенсируется теплотой, выделяющейся на стадии сольватации
Слайд 28

При растворении газов p H 0 , т.к. при их растворении атомизация не протекает (газообразные вещества не образуют кристаллических решеток )
Слайд 29

При растворении жидкостей друг в друге p H 0 , т.к. главной стадией растворения является диффузия, протекающая без заметного теплового эффекта.
Слайд 30

Как любой обратимый процесс, растворение доходит до равновесия. Раствор, находящийся в равновесии с избытком растворяемого вещества, называется насыщенным.
Слайд 31
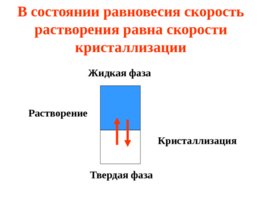
В состоянии равновесия скорость растворения равна скорости кристаллизации Жидкая фаза Твердая фаза Растворение Кристаллизация
Слайд 32

Растворы Ненасыщенные : содержат меньше растворенного вещества, чем насыщенные Насыщенные Пересыщенные : содержат больше растворенного вещества, чем насыщенные (неустойчивы)
Слайд 33

4 .3 Растворимость (S) - это способность вещества растворяться в данном растворители . Она равна содержанию растворенного вещества в его насыщенном растворе при данной температуре.
Слайд 34

Растворимость зависит от природы веществ и термодинамических параметров системы. Факторы, влияющие на растворимость
Слайд 35

Влияние природы веществ на растворимость описывается правилом: «Подобное растворяется в подобном».
Слайд 36

Другими словами, полярные вещества хорошо растворяются в полярных растворителях, а неполярные - в неполярных. Например: Na C l хорошо растворим в воде и плохо в бензоле; I 2 хорошо растворим в бензоле и плохо в воде.
Слайд 37

Растворение газов в воде можно представить схемой: А (г) Н 2 О А (р-р) р Н
Слайд 38

а) В соответствии с принципом Ле Шателье при повышении температуры равновесие смещается влево, т.е. растворимость уменьшается , а при понижении температуры – вправо, растворимость увеличивается.
Слайд 39
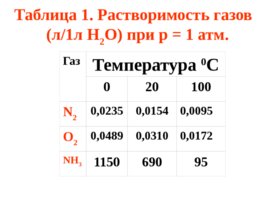
Газ Температу ра 0 С 0 20 100 N 2 0,0235 0,0154 0,0095 O 2 0,0489 0,0310 0,0172 NH 3 1150 690 95 Таблица 1. Растворимость газов
(л/1л Н 2 О) при р 1 атм.
Слайд 40

б) В соответствии с принципом Ле Шателье при увеличении давления равновесие смещается вправо, т.е. растворимость газов растет.
Слайд 41

Зависимость растворимости газа от давления описывается уравнением Генри (1803 г.): S k p, где k - константа Генри, p – давление газа над раствором.
Слайд 42

Закон Генри позволяет вскрыть причины возникновения кессонной болезни .
Слайд 43

Она возникает у водолазов, летчиков и представителей других профессий, которые по роду деятельности быстро переходят из среды с высоким давлением в среду с низким давлением.
Слайд 44

В период пребывания человека в среде с высоким давлением его кровь и ткани насыщаются азотом (N 2 ) и частично углекислым газом (СО 2 ) . Накопления кислорода не происходит, так как он расходуется на физиологические процессы в организме.
Слайд 45

При быстром переходе человека в среду с низким давлением происходит выделение избыточных количеств растворенных газов, которые не успевают диффундировать через легкие и образуют газовые пробки в тканях и кровеносных сосудах.
Слайд 46

Это приводит к закупорке и разрыву кровеносных капилляров, накоплению пузырьков газа в подкожной жировой клетчатке, в суставах, в костном мозге.
Слайд 47

Симптомы: головокружение, зуд, мышечные и загрудинные боли, нарушение дыхания, паралич и смерть.
Слайд 48

29 июня 1971 от кессонной болезни погибли трое советских космонавтов, возвращающихся на Землю.
Слайд 49

в) На растворимость газов влияет присутствие электролитов в растворе. Эта зависимость описывается уравнением Сеченова (1859 г.): S S 0 e -kc где S и S 0 - растворимость газа в растворе электролита и чистой воде, с - концентрация электролита, k - константа Сеченова
Слайд 50

Чем выше концентрация электролита в растворе, тем ниже растворимость газов. Вот почему растворимость газов в воде больше, чем в плазме.
Слайд 51
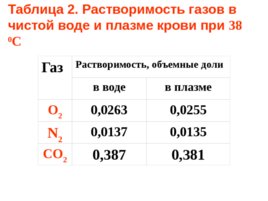
Газ Растворимость, объемные доли в воде в плазме О 2 0,0263 0,0255 N 2 0,0137 0,0135 CO 2 0,387 0 , 381
Таблица 2. Растворимость газов в чистой воде и плазме крови при 38 0 С
Слайд 52

Растворение жидкости в воде можно представить схемой:
А (ж) Н 2 О А (р-р)
Слайд 53

Основной стадией растворения жидкости в жидкости является диффузия, скорость которой возрастает с увеличением температуры.
Слайд 54

Соответственно, взаимная растворимость жидкостей усиливается с ростом температуры.
Слайд 55

Различают три типа жидкостей: а)неограниченно растворимые друг в друге: Н 2 SO 4 / Н 2 О , С 2 Н 5 ОН/Н 2 О; б) ограниченно растворимые: С 6 Н 6 /Н 2 О в) абсолютно нерастворимые: Hg/H 2 O.
Слайд 56

Если в систему из двух несмешивающихся жидкостей добавить третий компонент, то отношение его концентраций в каждой жидкости есть величина постоянная при данной температуре (закон Нернста- Шилова)
Слайд 57
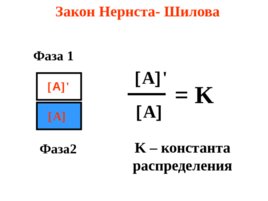
Закон Нернста- Шилова Фаза 1 Фаза 2 A A ' A ' A K K – константа распределения
Слайд 58

Закон Нернста-Шилова – теоретическая основа экстракции- одного из способов разделения смесей.
Слайд 59

Растворение твердых веществ описывается схемой:
А (к) Н 2 О А (р-р),
р Н О
Слайд 60

Гетерогенное равновесие между труднорастворимым электролитом (солью, основанием или кислотой) и его ионами в насыщенном растворе описывается схемой: A n B m ( к ) n A (aq) m B - (aq).
Слайд 61

Данное равновесие характеризуется при помощи константы растворимости K s , являющейся константой гетерогенного равновесия : K s A n B - m
Слайд 62
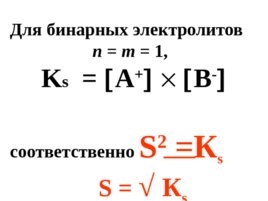
Для бинарных электролитов n m 1 , K s A B - соответственно S 2 К s S К s
Слайд 63
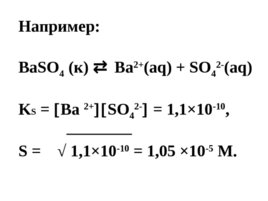
Например: Ba SO 4 ( к ) Ba 2 (aq) SO 4 2- (aq) K S Ba 2 SO 4 2- 1 , 1 10 -10 , S 1 , 1 10 -10 1 , 05 10 -5 M.
Слайд 64

Чем меньше K s , тем ниже растворимость вещества и легче формируется осадок труднорастворимого электролита.
Слайд 65

Осадок выпадает из насыщенных и пересыщенных растворов. В насыщенном растворе A B - K s В пересыщенном растворе A B - K s Условия образования осадка труднорастворимых электролитов
Слайд 66

Одним из наиболее важных гетерогенных процессов in vivo является образование костной ткани.
Слайд 67

Основным минеральным компонентом костной ткани является кальций гидроксофосфат (гидроксоаппатит) Са 5 (РО 4 ) 3 ОН.
Слайд 68

Формирование костной ткани
В крови при р Н 7,4 в приблизительно равных количествах находятся анионы НРО 4 2– и Н 2 РО 4 – , а также катионы Са 2 .
Слайд 69

К S (C а НРО 4 ) 2,7 10 –7 , К S (C а(Н 2 РО 4 ) 2 ) 1 10 –3 вследствие чего на первой стадии образуется менее растворимая соль Са НРО 4 : Са 2 НРО 4 2– Са НРО 4 Формирование костной ткани
Слайд 70

3Са НРО 4 Са 2 2ОН – Са 4 Н(РО 4 ) 3 2Н 2 О Са 4 Н(РО 4 ) 3 Са 2 2ОН – Са 5 (РО 4 ) 3 ОН Н 2 О К S (Са 5 (РО 4 ) 3 ОН) 10 -58 Формирование костной ткани
Слайд 71

При избытке ионов Са 2 в крови равновесие сдвигается вправо и наблюдается обызвествление костей.
Слайд 72

При недостатке Са 2 равновесие сдвигается влево, происходит разрушение костной ткани. У детей это приводит к рахиту , у взрослых развивается остеопороз
Слайд 73

У больного остеопорозом позвонки деформированы и истончены (слева),
У здорового человека позвонки не изменены, а костная ткань остаётся плотной (справа)
Слайд 74

При недостатке кальция в костной ткани его место могут занять ближайшие электронные аналоги: бериллий и стронций. Их накопление вызывает соответственно бериллиевый и стронциевый рахит (повышенная ломкость и хрупкость костей).
Слайд 75

При попадании радиоизотопа Sr -90 в костную ткань происходит облучение костного мозга, что может привести к лейкозу и другим онкологическим заболеваниям. Кальций блокирует накопление организмом радиоактивного стронция.
Слайд 76

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
