Слайды и текст этой онлайн презентации
Слайд 1
Типы химических реакций на примере свойств воды
Слайд 2
Безбрежная ширь океана…
Слайд 3
И тихая заводь пруда,
Слайд 6
Физические свойства воды:
И все это – только вода.
Вода бесцветная
и прозрачная жидкость,
без запаха
Т кип = 100 °С
Т зам = 0 °С
Слайд 7
Отрывок С.Щипачева «Читая Менделеева»?
«Ты знаешь газ легчайший – водород.
В соединенье с кислородом – это
Июньский дождь от всех своих щедрот,
Сентябрьские туманы на рассвете!»
Н2
О2
Н2О
Напишите формулы данных веществ. Составьте уравнение реакции разложения. Назовите каждое вещество
О каких веществах идет речь в отрывке из стихотворения
Слайд 8
Чтобы гору перейти и к вершине нам дойти. Нужно многое постичь, надо много сил вложить: Не бояться отвечать и вопросы задавать. Уравнения химических реакций писать, Знать, как их отличать, Все задания выполнять, друг у друга проверять. Цель свою тогда достигнем – О типах реакций все постигнем!
Слайд 10
Реакции замещения
Взаимодействие с оксидами
С оксидами активных металлов образует основания (щелочи): СаO + H2O → Са(OH)2
С оксидами неметаллов образует кислоты:
Р2O5+ 3H2O → 2H3РO4
Реакции соединения
Взаимодействие с металлами
С активными металлами образует основания (щелочи) и водород:
2Na + 2H2O → 2NaOH + H2
С менее активными металлами образует оксиды и водород:
Zn + H2O → ZnO + H2
С неактивными металлами не взаимодействует.
Слайд 11
Реакции обмена
Обменное взаимодействие вещества с водой, приводящие к их разложению, называется гидролизом
Аl2S3+ 6HOH = 2Al(OH)3 + 3H2S
CaC2 + 2 HOH = C2H2 + Ca(OH)2
Жилец из квартиры №26 решил помочь освободиться жильцу из квартиры №29 из его хлорида, но сам попал в западню. Почему?
Напишите уравнения реакции, определите тип реакции и поставьте коэффициенты.
Слайд 12
Кусочек лития пинцетом взят.
Отметьте, что условия обычны.
Опустим в воду — тут же результат:
Пошла реакция, она экзотермична.
Вмиг из воды наш щелочной металл
Газ водород активно вытесняет,
А тот, ликуя, что свободным стал,
Шипит и литий по воде гоняет.
Кружит металл, как шаловливый пес,
Как будто за хвостом своим гоняясь,
Потерю электронов перенес,
С гидроксогруппой в щелочь превращаясь:
Составьте уравнения реакции
А индикатор проливает свет
На появленье оснований сильных:
Раствор в малиновый окрасив цвет,
Групп подтвердит наличие гидроксильных
Слайд 13
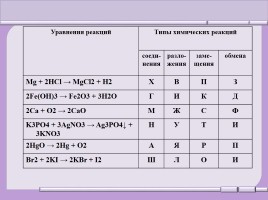
Уравнения реакций Типы химических реакций Типы химических реакций Типы химических реакций Типы химических реакций
Уравнения реакций соеди-
нения разло-
жения заме-
щения обмена
Mg + 2HCl → MgCl2 + H2 Х В П З
2Fe(OH)3 → Fe2O3 + 3H2O Г И К Д
2Ca + O2 → 2CaO М Ж С Ф
K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3 Н У Т И
2HgO → 2Hg + O2 А Я Р П
Br2 + 2KI → 2KBr + I2 Ш Л О И
Слайд 14
БЛАГОДАРЮ
ЗА РАБОТУ!
 Роль воды в химических реакциях
Роль воды в химических реакциях Типы химических реакций
Типы химических реакций Повторение «Типы химических реакций»
Повторение «Типы химических реакций» Основные типы химических реакций (8 класс)
Основные типы химических реакций (8 класс) Урок химии 9-10 класс «Химические свойства воды»
Урок химии 9-10 класс «Химические свойства воды» Проект «Типы предприятий общественного питания на примере г. Каменска-Уральского»
Проект «Типы предприятий общественного питания на примере г. Каменска-Уральского» Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы