Слайды и текст этой онлайн презентации
Слайд 1
«Строение ароматических углеводородов.
Ароматическая связь»
Слайд 2
История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Слайд 3
Второе рождение
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа.
Слайд 4
Майкл Фарадей выделил бензол из светильного газа 1825г
Слайд 5
«карбюрированный
водород»
Слайд 6
С6Н6
бензол
Ю. Либих
ОБЩАЯ ФОРМУЛА: СnH2n-6
Слайд 7
Новое получение
В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)
Слайд 8
Фридрих Август Кекуле 1865г
Слайд 10
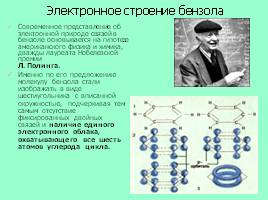
Электронное строение бензола
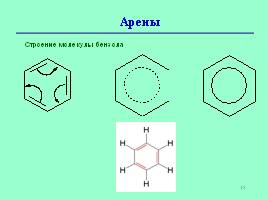
Современное представление об электронной природе связей в бензоле основывается на гипотезе американского физика и химика, дважды лауреата Нобелевской премии Л. Полинга.
Именно по его предложению молекулу бензола стали изображать в виде шестиугольника с вписанной окружностью, подчеркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Слайд 11
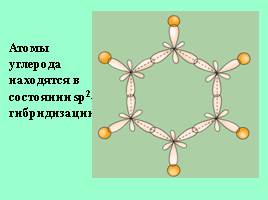
Атомы углерода находятся в состоянии sp2- гибридизации
Слайд 12
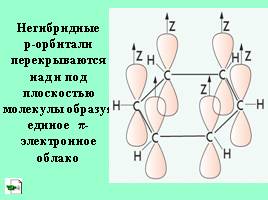
Негибридные р-орбитали перекрываются над и под плоскостью молекулы образуя единое π-электронное облако
Слайд 13
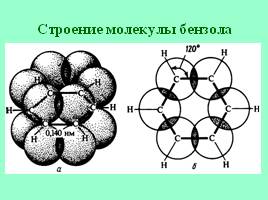
Строение молекулы бензола
Слайд 14
14
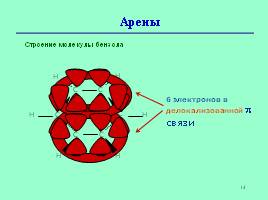
Арены
Строение молекулы бензола
6 электронов в делокализованной связи
Слайд 15
15
Арены
Строение молекулы бензола
Слайд 16
16
Арены
Строение молекулы бензола
Слайд 17
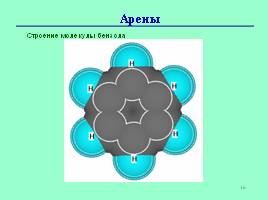
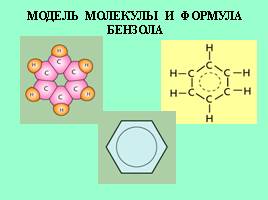
МОДЕЛЬ МОЛЕКУЛЫ И ФОРМУЛА БЕНЗОЛА
Слайд 18
Сочетание 6 сигма-связей с единой пи-системой называется АРОМАТИЧЕСКОЙ СВЯЗЬЮ
Цикл из 6 атомов углерода, связанных ароматической связью, называется бензольным кольцом (бензольным ядром).
Слайд 19
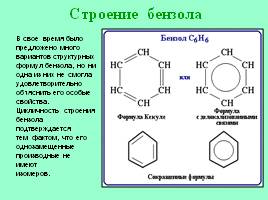
Строение бензола
В свое время было
предложено много
вариантов структурных
формул бензола, но ни
одна из них не смогла
удовлетворительно
объяснить его особые
свойства.
Цикличность строения
бензола подтверждается
тем фактом, что его
однозамещенные
производные не имеют
изомеров.
Слайд 20
ОБЩАЯ ФОРМУЛА:
СnH2n-6
СОДИНЕНИЯ УГЛЕРОДА И ВОДОРОДА, В МОЛЕКУЛАХ КОТОРЫХ ИМЕЕТСЯ БЕНЗОЛЬНОЕ КОЛЬЦО.
Ароматические углеводороды
Слайд 21
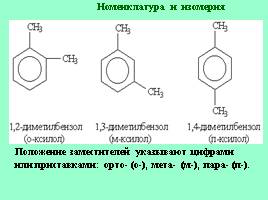
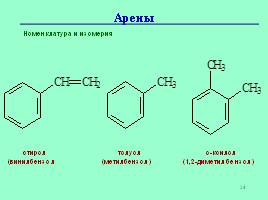
Положение заместителей указывают цифрами или приставками: орто- (о-), мета- (м-), пара- (п-).
Номенклатура и изомерия
Слайд 22
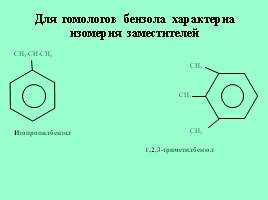
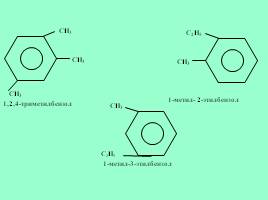
Для гомологов бензола характерна изомерия заместителей
CH3-CH-CH3
Изопропилбензол
CH3
CH3
CH3
1,2,3-триметилбензол
Слайд 23
CH3
CH3
CH3
1,2,4-триметилбензол
CH3
C2H5
1-метил- 2-этилбензол
CH3
1-метил-3-этилбензол
C2H5
Слайд 24
24
Арены
Номенклатура и изомерия
стирол
(винилбензол
толуол
(метилбензол)
о-ксилол
(1,2-диметилбензол)
Слайд 25
25
Арены
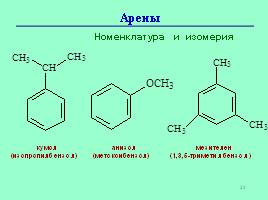
Номенклатура и изомерия
кумол
(изопропилбензол)
анизол
(метоксибензол)
мезителен
(1,3,5-триметилбензол)
Слайд 26
26
Арены
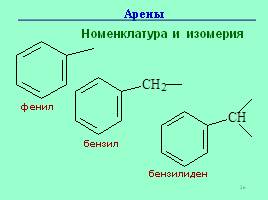
Номенклатура и изомерия
фенил
бензил
бензилиден
Слайд 27
Физические свойства
Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения +80ºС и температурой плавления + 5ºС.
Он обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней.
Пары бензола с воздухом образуют взрывчатую смесь.
Слайд 28
Химические свойства
1.Горение бензола:
2С6Н6 + 15О2 12СО2 + 6Н2О
2. Реакция замещения:
С6Н6 + Br2 C6H5Br + HBr
3. Нитрование:
С6Н6 + НОNО2 С6Н5NО2 + Н2О
4. Гидрирование:
С6Н6 + 3Н2 С6Н12
5. Хлорирование:
С6Н6 + 3 Cl2 C6H6Cl6
Слайд 29
Получение
Бензол получают из каменноугольной смолы, образующейся при коксовании угля.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими методами.
Слайд 30
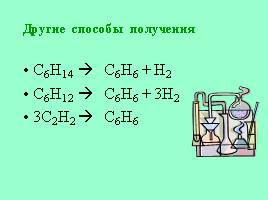
Другие способы получения
С6Н14 С6Н6 + Н2
С6Н12 С6Н6 + 3Н2
3С2Н2 С6Н6
Слайд 31
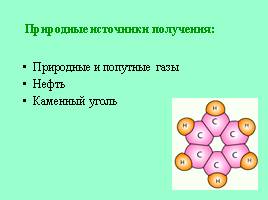
Природные источники получения:
Природные и попутные газы
Нефть
Каменный уголь
 Нетрадиционные техники рисования «Ароматическое рисование»
Нетрадиционные техники рисования «Ароматическое рисование» Основные виды словосочетаний - Их строение и значение - Связь слов в словосочетаниях
Основные виды словосочетаний - Их строение и значение - Связь слов в словосочетаниях Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов
Отдел Моховидные, особенности строения и жизнедеятельности - Значение мхов Твоё настроение
Твоё настроение Пропорции и построение головы человека 6 класс
Пропорции и построение головы человека 6 класс Ковалентная неполярная связь
Ковалентная неполярная связь Строение нервной системы:"Спинной мозг"
Строение нервной системы:"Спинной мозг"