Слайды и текст этой онлайн презентации
Слайд 1
МОЛЕКУЛЯРНАЯ ФИЗИКА
Слайд 2
ГЛАВЫ
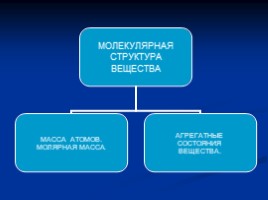
МОЛЕКУЛЯРНАЯ СТРУКТУРА ВЕЩЕСТВА.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА.
ТЕРМОДИНАМИКА.
ЖИДКОСТЬ-ПАР.
ТВЕРДОЕ ТЕЛО.
Слайд 3
Молекулярная физика – это раздел физики, изучающий внутреннее строение тел, а также тепловые процессы, происходящие внутри вещества. Молекула (с греч.- «массочка»)- наименьшая устойчивая частица вещества, обладающая его химическими свойствами. МОЛЕКУЛЫ ОБРАЗУЮТСЯ ИЗ АТОМОВ. Атом – (с греч. – «неделимый») – наименьшая частица химического элемента, носитель его свойст.
Слайд 5
Величины рассматривающиеся в МКТ
Число Авогадро – число атомов в 12 граммах углерода.
Nа = 6,02 * 10²³ мольֿ¹
Количества вещества – это количество вещества, в котором содержится столько же частиц, сколько атомов в 12 граммах углерода.
V=N/ Nа
V- количество вещества
N- число частиц
Молярной массой М называется величина, равная отношению массы вещества m к количеству вещества ν (ню)
М = m/V
Слайд 6
Основные положения МКТ
Все тела (вещества) состоят из частиц (молекул, атомов, ионов… ) между которыми есть промежутки.
Опытные обоснования:
- крошение вещества;
-испарение жидкости;
-смешивание веществ; диффузия;
-фотография туннельного микроскопа.
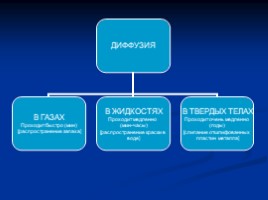
Частицы находятся в постоянном, беспорядочном (хаотичном) движении (тепловое движение)
Опытные обоснования:
Испарение (вылет частиц с поверхности вещества);
Диффузия (самопроизвольное проникновение частиц одного вещества в промежутки между частицами другого вещества (чем больше температура, тем быстрее происходит диффузия))
Слайд 8
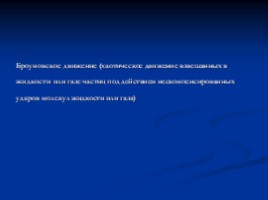
Броуновское движение (хаотическое движение взвешанных в жидкости или газе частиц под действием нескомпенсированных ударов молекул жидкости или газа)
Слайд 9
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА.
Температура тела – мера средней кинетической энергии хаотического поступательного движения его молекул.
Абсолютный нуль температуры- температура, при которой должно прекратиться движение молекул.
T = t + 273
Слайд 10
ОСНОВНОВНЫЕ УРАВНЕНИЯ МКТ:
Давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема
p=2/3 nEк,
где n – концентрация молекул
Слайд 12
ТЕРМОДИНАМИКА (от термо... и динамика), раздел физики, изучающий наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. (Неравновесные процессы изучает термодинамика неравновесных процессов.) Термодинамика строится на основе фундаментальных принципов — начал термодинамики, которые являются обобщением многочисленных наблюдений и результатов экспериментов Термодинамика возникла в 1-й пол. 19 в. в связи с развитием теории тепловых машин (С. Карно) и установлением закона сохранения энергии (Ю. Р. Майер, Дж. Джоуль, Г. Гельмгольц). Основные этапы развития термодинамики связаны с именами Р. Клаузиуса и У. Томсона (формулировки второго начала термодинамики), Дж. Гиббса (метод термодинамических потенциалов), В. Нернста (третье начало термодинамики) и др. Различают химическую термодинамику, техническую термодинамику и термодинамику различных физических явлений.
Слайд 13
Термодинамика.
Внутренняя энергия тела – сумма кинетической энергии хаотического теплового движения частиц (атомов или молекул) тела и потенциальной энергии их взаимодействия.
U- внутренняя энергия
[U] – Дж
U=Ек + Ер (1)
U=3/2 m/M RT (2)
U=3/2 pV (3)
Слайд 14
АДИАБАТНЫЙ ПРОЦЕСС (адиабатический процесс), термодинамический процесс, при котором система не получает теплоты извне и не отдает ее. Быстропротекающие процессы (напр., распространение звука) могут приближенно рассматриваться как адиабатный процесс и при отсутствии теплоизолирующей оболочки.
 Молекулярная физика и Основы термодинамики
Молекулярная физика и Основы термодинамики Блок подготовки к егэ по физике. Молекулярная физика
Блок подготовки к егэ по физике. Молекулярная физика Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Проектная деятельность на уроках физики
Проектная деятельность на уроках физики ГИА 2020 физика особенности проведения структура и содержание КИМ
ГИА 2020 физика особенности проведения структура и содержание КИМ «Исследование микроклимата кабинета физики с использованием цифровых датчиков releon lite»
«Исследование микроклимата кабинета физики с использованием цифровых датчиков releon lite» Физика - это здорово
Физика - это здорово