Презентация - Химический источник электрического тока
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 98%
- Слайдов: 7
- Просмотров: 5927
- Скачиваний: 2797
- Размер: 1.19 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Химические источники тока. Электролиз (химия)
Химические источники тока. Электролиз (химия) Источники электрического тока
Источники электрического тока Электрический ток. Источники электрического тока
Электрический ток. Источники электрического тока Работа и мощность электрического тока, тепловое действие тока
Работа и мощность электрического тока, тепловое действие тока Электрический ток в металлах. Действие электрического тока. Направление электрического тока
Электрический ток в металлах. Действие электрического тока. Направление электрического тока Работа и мощность электрического тока
Работа и мощность электрического тока Действие электрического тока на человека
Действие электрического тока на человека
Слайды и текст этой онлайн презентации
Слайд 1

Муниципальное бюджетное учреждение дополнительного образования Первомайского района города Ростова-на-Дону «Дом детского творчества»
Тема: «Химический источник электрического тока»
Бобыльченко Валерий Юрьевич
Педагог дополнительного образования
МБУ ДО ДДТ Первомайского р-на
2019 г.
Слайд 2

Актуальность темы
В технике и быту постоянно растет число таких приборов и устройств, для которых требуются автономные, малогабаритные легкие и надежные источники тока. Гальванический элемент или, проще говоря – батарейка, огромную мощность не способна дать, но без неё невозможно обойтись в тех случаях, когда обычная сеть не доступна либо не целесообразно.
Цель Изготовить простейший гальванический элемент Задачи - Ознакомление с историей создания первых гальванических элементов. - Изучить устройство и принцип действия гальванических элементов. - Гальванические элементы сегодня. - Самостоятельно изготовить рабочий гальванический элемент с подключением нагрузки.
Цель Изготовить простейший гальванический элемент Задачи - Ознакомление с историей создания первых гальванических элементов. - Изучить устройство и принцип действия гальванических элементов. - Гальванические элементы сегодня. - Самостоятельно изготовить рабочий гальванический элемент с подключением нагрузки.
Слайд 3

Принцип работы
Растворы солей, кислот, щелочей в воде или другом растворителе называются электролитами.
Поместим в ёмкость с электролитом медную и цинковую пластинку. На первой образовались пузырьки газа, вторая начинала растворяться. Принцип работы заключается в том, что два вида металла в электролитической среде вступают во взаимодействие, в результате которого по внешней цепи начинает проходить ток.
Характер электродных процессов в гальваническом элементе определяется значениями электродных потенциалов. Окисление протекает на поверхности металлического проводника электрода, содержащего наиболее сильный восстановитель, т.е. анодом является электрод с меньшим значением электродного потенциала; электрод с большим значением электродного потенциалаявляется катодом.Соответственно относительным величинам электродных потенциалов анод в гальванических элементах маркируется знаком“”, катод – знаком“+”.
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Слайд 4

В 1786 итальянский профессор медицины, физиолог Луиджи Алоизио Гальвани обнаружил: мышцы задних лапок свежевскрытого трупика лягушки, подвешенного на медных крючках, сокращались, когда ученый прикасался к ним стальным скальпелем. Гальвани тут же сделал вывод, что это — проявление «животного электричества».
В 1800 году придет к однозначному выводу о том, что: «проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления».
Им был изобретён «элемент Вольта» — первый гальванический элемент, в форме вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой.
1802 - русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. 1836 - английский химик Джон Дэниель поместил цинковый и медный электроды в раствор серной кислоты («элемент Даниэля»). 1859 - французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. 1865 - французский химик Ж. Лекланше (элемент Лекланше) - цинковый стаканчик, заполненный водным раствором хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом (солевые батарейки). 1890 в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик.
В 1800 году придет к однозначному выводу о том, что: «проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления».
Им был изобретён «элемент Вольта» — первый гальванический элемент, в форме вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой.
1802 - русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. 1836 - английский химик Джон Дэниель поместил цинковый и медный электроды в раствор серной кислоты («элемент Даниэля»). 1859 - французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. 1865 - французский химик Ж. Лекланше (элемент Лекланше) - цинковый стаканчик, заполненный водным раствором хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом (солевые батарейки). 1890 в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик.
Слайд 5

Гальванические элементы сегодня - батарейки. Широко распространены три типа батареек:
Принцип их работы — все тот же, описанный Вольта в 1800 году: два металла взаимодействуют через электролит, и во внешней замкнутой цепи возникает электрический ток. Напряжение батарейки зависит как от используемых металлов, так и от количества элементов в «батарейке». Батарейки, в отличие от аккумуляторов, не способны к восстановлению своих свойств, поскольку в них происходит прямое преобразование энергии химической, то есть энергии составляющих батарейку реагентов (восстановителя и окислителя), в энергию электрическую.
Солевые (сухие)
Щелочные (их называют еще алкалиновыми, «alkaline» в переводе с английского - «щелочной»)
Литиевые
Принцип их работы — все тот же, описанный Вольта в 1800 году: два металла взаимодействуют через электролит, и во внешней замкнутой цепи возникает электрический ток. Напряжение батарейки зависит как от используемых металлов, так и от количества элементов в «батарейке». Батарейки, в отличие от аккумуляторов, не способны к восстановлению своих свойств, поскольку в них происходит прямое преобразование энергии химической, то есть энергии составляющих батарейку реагентов (восстановителя и окислителя), в энергию электрическую.
Солевые (сухие)
Щелочные (их называют еще алкалиновыми, «alkaline» в переводе с английского - «щелочной»)
Литиевые
Слайд 6

Ряд напряжений металлов – необходим в нашем случае. Мы, как и Алессандро Вольта, будем знать – чем дальше металлы отстоят друг от друга, тем большее напряжение удастся получить.
В своих опытах, как и классики, мы использовали медь и цинк. При погружении пластинок в электролит, между ним и цинковой пластинкой, происходит химическая реакция, в результате которой на пластинке скапливаются отрицательные заряды и она заряжается отрицательно. В результате реакции происходящей в гальваническом элементе, цинковый электрод постепенно растворяется.
Практическая часть
Практическая часть
Слайд 7
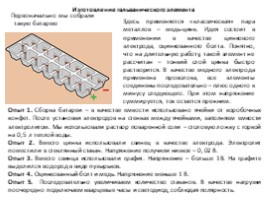
Изготовление гальванического элемента
Первоначально мы собрали такую батарею
Здесь применяется «классическая» пара металлов – медь-цинк. Идея состоит в применении в качестве цинкового электрода, оцинкованного болта. Понятно, что на длительную работу, такой элемент не рассчитан – тонкий слой цинка быстро растворится. В качестве медного электрода применена проволока, все элементы соединены последовательно – плюс одного к минусу следующего. При этом напряжение суммируется, ток остается прежним.
Опыт 1. Сборка батареи – в качестве емкости использовано ячейки от коробочных конфет. После установки электродов на стенках между ячейками, заполняем емкости электролитом. Мы использовали раствор поваренной соли – столовую ложку с горкой на 0,5 л теплой воды. Опыт 2. Вместо цинка использовали свинец в качестве электрода. Электролит поместили в стеклянный стакан. Напряжение получили низкое – 0, 02 В. Опыт 3. Вместо свинца использовали графит. Напряжение – больше 1В. На графите выделился водород в виде пузырьков. Опыт 4. Оцинкованный болт и медь. Напряжение меньше 1 В. Опыт 5. Последовательно увеличиваем количество стаканов. В качестве нагрузки поочередно подключаем кварцевые часы и светодиод, соблюдая полярность.
Первоначально мы собрали такую батарею
Здесь применяется «классическая» пара металлов – медь-цинк. Идея состоит в применении в качестве цинкового электрода, оцинкованного болта. Понятно, что на длительную работу, такой элемент не рассчитан – тонкий слой цинка быстро растворится. В качестве медного электрода применена проволока, все элементы соединены последовательно – плюс одного к минусу следующего. При этом напряжение суммируется, ток остается прежним.
Опыт 1. Сборка батареи – в качестве емкости использовано ячейки от коробочных конфет. После установки электродов на стенках между ячейками, заполняем емкости электролитом. Мы использовали раствор поваренной соли – столовую ложку с горкой на 0,5 л теплой воды. Опыт 2. Вместо цинка использовали свинец в качестве электрода. Электролит поместили в стеклянный стакан. Напряжение получили низкое – 0, 02 В. Опыт 3. Вместо свинца использовали графит. Напряжение – больше 1В. На графите выделился водород в виде пузырьков. Опыт 4. Оцинкованный болт и медь. Напряжение меньше 1 В. Опыт 5. Последовательно увеличиваем количество стаканов. В качестве нагрузки поочередно подключаем кварцевые часы и светодиод, соблюдая полярность.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
