Слайды и текст этой онлайн презентации
Слайд 1
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОЛИЗ
Марчукова И.Ю.
учитель химии
Слайд 2
Химические источники тока
Устройства, превращающие химическую энергию окислительно-восстановительных реакций в электрическую
2
Слайд 3
Гальванические элементы
На практике наиболее распространены сухие гальванические элементы
Применяют как источники питания в системах сигнализации, часах, калькуляторах, аудиосистемах, игрушках, радио, пультах дистанционного управления и т.д.
Принцип работы и устройство сходны, различия в химической природе электродов
3
Слайд 4
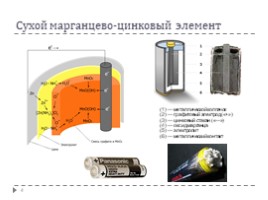
Сухой марганцево-цинковый элемент
4
(1) — металлической колпачок (2) — графитовый электрод («+») (3) — цинковый стакан («—») (4) — оксид марганца (5) — электролит (6) — металлический контакт
Слайд 5
Аккумуляторы
Устройства, в которых поэтапно происходит преобразование электрической энергии в химическую, а химической - в электрическую
Агрегат многоразового действия, сочетающий в себе гальванический элемент и электролизёр
Процесс накопления химической энергии под действием внешнего постоянного тока называют зарядкой аккумулятора (работает как электролизёр)
Процесс превращения химической энергии в электрическую называют разрядкой аккумулятора (работает как гальванический элемент)
5
Слайд 6
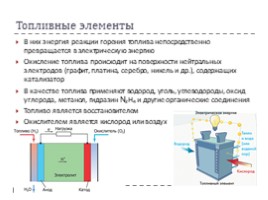
Топливные элементы
В них энергия реакции горения топлива непосредственно превращается в электрическую энергию
Окисление топлива происходит на поверхности нейтральных электродов (графит, платина, серебро, никель и др.), содержащих катализатор
В качестве топлива применяют водород, уголь, углеводороды, оксид углерода, метанол, гидразин N₂H₄ и другие органические соединения
Топливо является восстановителем
Окислителем является кислород или воздух
6
Слайд 7
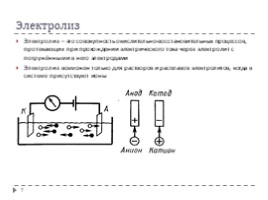
Электролиз
Электролиз – это совокупность окислительно-восстановительных процессов, протекающих при прохождении электрического тока через электролит с погружёнными в него электродами
Электролиз возможен только для растворов и расплавов электролитов, когда в системе присутствуют ионы
7
Слайд 9
Практическое применение электролиза
Электролизом раствора NaCl получают гидроксид натрия, хлор и водород
Электролизом воды получают кислород и водород высокой чистоты
Получают многие сильные окислители: гипохлорит натрия NaClO, хлорат натрия NaClO₃, хлорную кислоту HClO₄ и её соли, пероксид водорода H₂O₂, перманганат калия KMnO₄, дихромат калия K₂Cr₂O₇ и др.
В металлургии получают металлы (золото, серебро, медь, никель, алюминий и др.)
Электролиз с растворимым анодом используют при электролитическом рафинировании (очистке) черновых металлов (меди, серебра, олова и др.); металл, подвергаемый очистке, является анодом
Гальванопластика – получение изделий путём осаждения металла на модели
Гальваностегия – нанесение металлических покрытий путём электролиза
9
Слайд 10
Спасибо за внимание
10
 Химический источник электрического тока
Химический источник электрического тока Источники электрического тока
Источники электрического тока Электрический ток - Источники тока
Электрический ток - Источники тока Общая химия - раздел химической науки, изучающий основные законы, описывающие химические процессы, протекающие в живой и неживой природе
Общая химия - раздел химической науки, изучающий основные законы, описывающие химические процессы, протекающие в живой и неживой природе Электрический ток. Источники электрического тока
Электрический ток. Источники электрического тока По дисциплине «медицинская информатика» на тему « источники данных по доказательной медицине»
По дисциплине «медицинская информатика» на тему « источники данных по доказательной медицине» Химия в жизни общества
Химия в жизни общества