Презентация - Комплексные соединения
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 85%
- Слайдов: 85
- Просмотров: 6792
- Скачиваний: 3137
- Размер: 0.18 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 13 Комплексные соединения
Слайд 2

П Л А Н 13.1 Основные понятия химии комплексных соединений(КС) . 13.2 Строение КС . 13.3 Металло-лигандное равновесие в растворах . 13.4 Биологическая роль КС .
Слайд 3

13.1 Комплексными (координационными) соединениями называют вещества, в структурных единицах которых число связей, образованных центральным атомом, превышает его высшую валентность.
Слайд 4
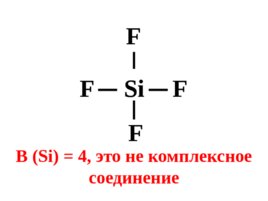
Si F F F F В (Si) 4, это не комплексное соединение
Слайд 5
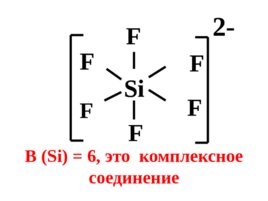
Si F F F F В (Si) 6, это комплексное соединение F F 2-
Слайд 6
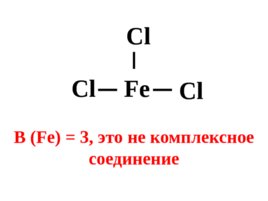
Fe Cl Cl Cl В (Fe) 3 , это не комплексное соединение
Слайд 7
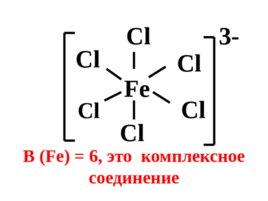
Fe Cl Cl Cl Cl В (Fe) 6, это комплексное соединение Cl Cl 3-
Слайд 8

Комплексные соединения состоят из: комплексообразователей (Ме, реже неметаллы: Si , P и др.); лигандов (ионов или поляр-ных молекул); ионов внешней сферы (могут отсутствовать).
Слайд 9

Слайд 10

В природе комплексных соединений больше, чем простых. Их изучение началось 200 лет назад. Первой теорией КС была теория А. Вернера (1893).
Слайд 11

Альфред Вернер 1866-1919 Швейцарский химик, выдвинувший и развивший координационную теорию строения комплексных соединений. Лауреат Нобелевской премии 1913 г.
Слайд 12

Важнейшей характе-ристикой комплексо-образователя является его координационное число (к.ч.), т.е. число связей, образованных им с лигандами.
Слайд 13

Степень к.ч. окисления Ме 1 2 2 4, 6 3 4, 6 4 6, 8
Слайд 14

Важнейшей характеристикой лиганда является его дентантность – число связей, образованных с комплексообразователем.
Слайд 15

Классификация лигандов монодентантные лиганды: а) анионы : OH , H , F , Cl , Br , I , CN , CNS , NO 2 , NO 3 ; б) молекулы : NH 3 , H 2 O, CO ; в) катионы : NH 2 NH 3 .
Слайд 16

бидентантные лиганды а) анионы : SO 4 2 , C 2 O 4 2 , CO 3 2 ; б) молекулы : NH 2 – CH 2 – CH 2 – NH 2 ( этилендиамин ) NH 2 – CH 2 – COOH (глицин)
Слайд 17

полидентантные ли-ганды. Важнейшими из них являются комплексоны – аминополикарбоновые кислоты и их соли.
Слайд 18

Этилендиаминтетрауксусная кислота (ЭДТА)
Слайд 19

Динатриевая соль ЭДТА ( Na 2 H 2 Y ) Трилон Б дентантность от 4 до 6
Слайд 20

Комплексоны находят применение в медицине для лечения мочекаменной болезни: Ca C 2 O 4 Na 2 H 2 Y Ca Y 2 Na 2 C 2 O 4 2 H
Слайд 21

Метод комплексонометрии является одним из методов объемного анализа, в основе которого лежит реакция комплексообразования: Me 2 Na 2 H 2 Y Me Y 2 2 Na 2 H
Слайд 22

Метод комплексонометрии позволяет определять содержание катионов металлов Ca 2 , Mg 2 , Fe 2 , Fe 3 и др. в растворах и биологических жидкостях.
Слайд 23

1) по природе лигандов Классификация комплексных соединений А) КС с монодентантными лигандами : аммиакаты Cu(NH 3 ) 4 Cl 2 аквакомплексы Cu ( H 2 O ) 4 SO 4 гидроксокомплексы Na Al(OH) 4 ацидокомплексы Na Ag(CN) 2 со смешанными Pt(NH 3 ) 2 Cl 2 лигандами
Слайд 24

Б) КС с би- и полидентантными лигадами Особую группу составляют хелатные (клешневидные) комплексы, содержащие полидентантные лиганды, образующие замкнутые циклы
Слайд 25

Слайд 26

Наиболее устойчивыми являются внутрикомплексные КС, в которых часть связей Me - Lig образованы по обменному, а часть – по донорно-акцепторному механизму
Слайд 27

С u (Гли) 2
Слайд 28

Тетацин Na 2 Ca Y
Слайд 29

Тетацин применяется в медицине как лекарственный препарат для детоксификации организма при отравлении тяжелыми металлами): Hg 2 Ca Y 2 Ca 2 Hg Y 2
Слайд 30
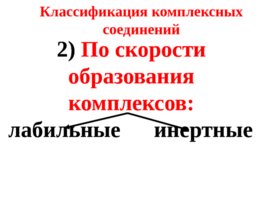
2) По скорости образования комплексов: лабильные инертные Классификация комплексных соединений
Слайд 31

НОМЕНКЛАТУРА КС (1960, ИЮПАК) 1) вначале называют катионы, затем анионы. Названия комплексных анионов заканчиваются суффиксом – ат ;
Слайд 32

2) В комплексном ионе сначала называют лиганды-анионы, затем лиганды-молекулы, затем лиганды-катионы: NH 3 – аммин H 2 O – аква СО – карбонил
Слайд 33

Названия лигандов-анионов заканчиваются на – о: OH – гидроксо NO 2 – нитро NO 3 –нитрато CN – циано С NS – родано SO 4 2 –сульфато NH 2 NH 3 Катион-лиганд гидразиниум
Слайд 34

Названия некоторых комплексообразо-вателей зависит от их положения в КС
Слайд 35

Ме Названия В комплексном катионе В комплексном анионе Fe Hg Au Ag Cu Sn Железо Ртуть Золото Серебро Медь Олово Феррат Меркурат Аурат Аргентат Купрат Станат Ме Названия В комплексном катионе В комплексном анионе Fe Hg Au Ag Cu Sn Железо Ртуть Золото Серебро Медь Олово Феррат Меркурат Аурат Аргентат Купрат Станат
Слайд 36

Степень окисления комплексообразователя указывают, если у металла их несколько.
Слайд 37

Na Al(OH) 4 натрий тетрагидроксоалюминат Cu ( NH 3 ) 4 SO 4 тетраамминмедь( II ) сульфат NH 4 Co ( NH 3 ) 2 ( NO 2 ) 4 аммоний тетранитродиамминкобальтат( III ) Pt(NH 3 ) 2 Cl 2 дихлородиамминплатина
Слайд 38

13.2 Строение КС описывается либо в рамках метода ВС , либо с позиций теории кристаллического поля.
Слайд 39

С позиций метода ВС связи металл-лиганд являются ковалентными полярными, образованными по донорно-акцепторному механизму.
Слайд 40

Лиганды выступают в роли доноров электронных пар , а комплексообразователи – в роли их акцепторов .
Слайд 41
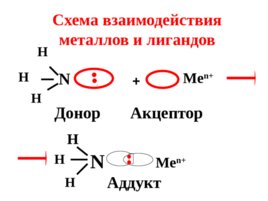
N H H H . Донор Me n Акцептор N H H H Me n Аддукт Схема взаимодействия металлов и лигандов .
Слайд 42

Конфигурация комплексного иона определяется типом гибридизации АО комплексообразова - теля.
Слайд 43
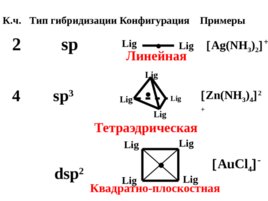
К.ч. Тип гибридизации Конфигурация Примеры 2 sp Lig Lig Ag(NH 3 ) 2 4 sp 3 Zn(NH 3 ) 4 2 Линейная Lig Lig Lig Lig Тетраэдрическая dsp 2 Lig Lig Lig Lig Квадратно-плоскостная Au Cl 4 -
Слайд 44
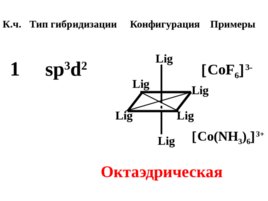
К.ч. Тип гибридизации Конфигурация Примеры sp 3 d 2 Lig Lig Lig Lig Lig Lig Co F 6 3- Co(NH 3 ) 6 3 Октаэдрическая
Слайд 45

Теория кристаллического поля исходит из того, что металлы и лиганды связаны между собой силами электростатического притяжения.
Слайд 46

Эта теория рассматривает воздействие лигандов на d- орбитали иона-комплексообразова-теля.
Слайд 47

Если катион металла находится в симметричном магнитном поле , его d- орбитали имеют одинаковый запас энергии (являются вырожденными ).
Слайд 48

Если ион находится в октаэдрическом, тетраэдрическом или другом несимметричном поле лигандов, то происходит расщепление его d- подуровня.
Слайд 49
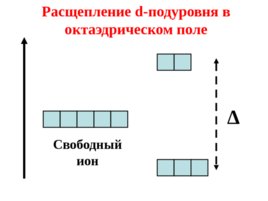
Свободный ион Расщепление d- подуровня в октаэдрическом поле
Слайд 50
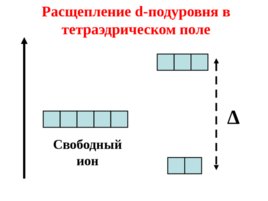
Свободный ион Расщепление d- подуровня в тетраэдрическом поле
Слайд 51

Величина энергии расщепления ( ) зависит от конфигурации комплекса и природы лиганда.
Слайд 52

Спектрохимический ряд лигандов I , Cl ,F , OH ,H 2 O,CNS , NH 3 ,NO 2 , CN Слабые Lig Сильные Lig Увеличение энергии расщепления
Слайд 53

В поле слабых лигандов энергия расщепления ( ) не велика, поэтому распределение электронов на d- орбиталях соответствует правилу Гунда
Слайд 54

В поле сильных лигандов энергия расщепления ( ) имеет большое значение, в следствие чего первыми заполняются d- орбитали нижнего подуровня (распределение электронов происходит против правила Гунда).
Слайд 55

Рассмотрим строение КС: Fe F 6 3 Fe(CN) 6 3 х – 6 – 3 х 3 х -1 х -1
Слайд 56

Координационное число катиона Fe 3 равно 6, так как он связан с шестью монодентантными лигандами
Слайд 57

Fe 4s 2 3d 6 Fe 3 4s 0 3d 5 Электронная конфигурация атома и иона
Слайд 58

Оба комплексных иона имеют октаэдрическую конфигурацию, что обуславливает одинаковый характер расщепления d- орбиталей
Слайд 59

F - является «слабым лигандом» ( 112,7 к Дж/моль) , поэтому распределение электронов катиона Fe 3 происходит в соответствии с правилом Гунда
Слайд 60

CN - является «сильным лигандом» ( 1464,8 к Дж/моль) , поэтому распределение электронов катиона Fe 3 происходит против правила Гунда
Слайд 61
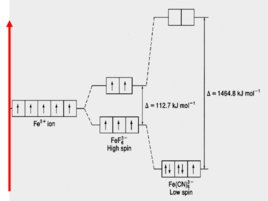
Слайд 62

Ион Fe F 6 3- парамагнитен , так как содержит неспаренные электроны на внешнем уровне (высокоспиновый комплекс) .
Слайд 63

Ион Fe (С N) 6 3- диамагнитен , (низкоспиновый комплекс) .
Слайд 64
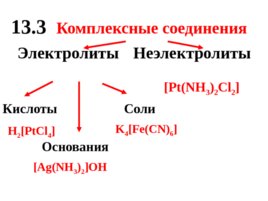
13. 3 Комплексные соединения Электролиты Неэлектролиты Кислоты Основания Соли H 2 Pt Cl 4 Ag(NH 3 ) 2 OH Pt ( NH 3 ) 2 Cl 2 K 4 Fe(CN) 6
Слайд 65

Различают первичную (необратимую) диссоциацию: K 4 Fe(CN) 6 4 K Fe(CN) 6 4 и вторичную (обратимую) диссоциацию КС: Fe(CN) 6 4 Fe 2 6 CN
Слайд 66

Константа равновесия, описывающая вторичную диссоциацию КС, называется константой нестойкости (К н ) : К н
Слайд 67

Чем меньше К н , тем устойчивее комплексное соединение Ag(NO 2 ) 2 Ag(NH 3 ) 2 Ag(CN) 2 1,3 10 3 6,8 10 8 1,0 10 21 увеличение устойчивости КС
Слайд 68

Устойчивость комплексов можно охарактеризовать при помощи константы устойчивости (К у ): К у 1 К н
Слайд 69

Причины устойчивости КС лежат в их строении: а) чем меньше ионный радиус комплексообразователя и больше его заряд, тем сильнее притяжение лигандов и устойчивее КС .
Слайд 70

s-Me p-Me d-Me увеличение комплексообразующей способности
Слайд 71

б) чем выше дентантность лиганда, тем устойчивее КС: К C К н Co(NH 3 ) 4 2 1 ,0 10 5 Co( Гли ) 2 3,3 10 9 Co Y 2 1,0 10 16
Слайд 72

Самыми устойчивыми комплексными соединениями являются хелатные КС. Это явление получило название эффекта хелатирования.
Слайд 73

13.4 В организме человека все металлы, кроме щелочных и, частично, щелочноземельных находятся в виде прочных хелатных КС с биолигандами: белками, аминокислотами, витаминами, гормонами и другими биоактивными соединениями.
Слайд 74

Важнейшими являются комплексы с белками. К ним относятся многочисленные металлоферменты, а так же гемоглобин (комплекс железа с порфином), хлорофилл (комплекс магния).
Слайд 75

Порфин – биолиганд, входящий в состав гемоглобина, хлорофилла, цитохромов С и некоторых других биосоединений
Слайд 76

Сбалансированные потоки металлов и лигандов в биосистемах обуславливают металло-лигандный гомеостаз.
Слайд 77

Его нарушение приводит к различным заболеваниям: При недостатке железа – анемия , при его избытке – сидероз.
Слайд 78

По данным ВОЗ дефицит железа в организме человека является одной из наиболее серьезных проблем современности. На земном шаре от дефицита железа страдает 4-5 миллиардов человек (66-80% населения Земли). Недостаток железа - один из десяти глобальных факторов риска, являющийся причиной смерти 800 000 человек в год.
Слайд 79

Недостаток кальция приводит к остеопорозу , а его избыток в организме человека способствует развитию катаракты, атеросклероза, а также обызвествлению костной ткани.
Слайд 80

Для коррекции металло-лигандного гомеостаза используются: комплексоны , связывающие токсичные металлы, и выводящие их из организма человека;
Слайд 81

комплексные соединения: А) комплексы Pt –противоопухолевые препараты, например, соль Пейроне Pt ( NH 3 ) 2 Cl 2 (синтезирована в 1850, используется как препарат с 1969 года);
Слайд 82

Б) комплексы Au – лечение артритов и туберкулеза: Na 3 Au ( S 2 O 3 ) 2 ; B) тетацин –при отрав - лениях тяжелыми Ме.
Слайд 83

Строение, свойства и биологическая роль КС металлов с биолигандами является объектом изучения бионеорганической химии , возникшей в середине 50-х годов, на стыке неорганической химии, биологии и медицины.
Слайд 84

Достижения бионеорганики широко внедряются в медицину.
Слайд 85

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.