Презентация - Плазмиды
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 91%
- Слайдов: 31
- Просмотров: 6532
- Скачиваний: 2516
- Размер: 0.71 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Плазмиды Плазмида – это внехромосомная ДНК бактерий. Отличительные признаки плазмид: Обычно кольцевая двуцепочечная форма (редко бывают линейные плазмиды, еще реже и обычно временно – одноцепочечные (продукты абортивной репликации), Автономная от хромосомной ДНК репликация по другим механизмам , Размеры – от тысяч до сотен тысяч пар оснований, Содержат гены, кодирующие РНК и белки, Почти никогда не содержат генов, обязательных для жизнедеятельности бактерий, чаще всего кодируют белки, дающие бактерии преимущества при неких возможных условиях среды. (Хотя, например, у холерного вибриона имеются две практически одинаковые по размеру кольцевые молекулы ДНК, обе кодирующие essential гены, и одну из них относят к плазмидам только потому, что у нее нехромосомный механизм репликации). Плазмиды – основные участники процесса горизонтального переноса генов!
Слайд 2
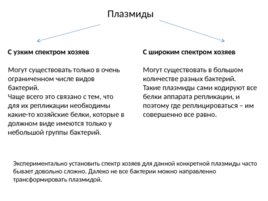
Плазмиды С узким спектром хозяев Могут существовать только в очень ограниченном числе видов бактерий. Чаще всего это связано с тем, что для их репликации необходимы какие-то хозяйские белки, которые в должном виде имеются только у небольшой группы бактерий. С широким спектром хозяев Могут существовать в большом количестве разных бактерий. Такие плазмиды сами кодируют все белки аппарата репликации, и поэтому где реплицироваться – им совершенно все равно. Экспериментально установить спектр хозяев для данной конкретной плазмиды часто бывает довольно сложно. Далеко не все бактерии можно направленно трансформировать плазмидой.
Слайд 3
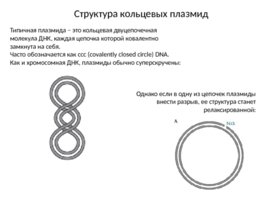
Структура кольцевых плазмид Типичная плазмида – это кольцевая двуцепочечная молекула ДНК, каждая цепочка которой ковалентно замкнута на себя. Часто обозначается как ссс (covalently closed circle) DNA. Как и хромосомная ДНК, плазмиды обычно суперскручены: Однако если в одну из цепочек плазмиды внести разрыв, ее структура станет релаксированной:
Слайд 4
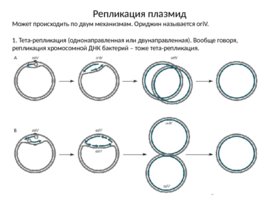
Репликация плазмид Может происходить по двум механизмам. Ориджин называется ori V. 1. Тета-репликация (однонаправленная или двунаправленная). Вообще говоря, репликация хромосомной ДНК бактерий – тоже тета-репликация.
Слайд 5
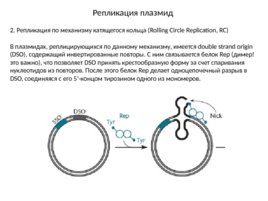
Репликация плазмид 2. Репликация по механизму катящегося кольца (Rolling Circle Replication, RC) В плазмидах, реплицирующихся по данному механизму, имеется double strand origin (DSO), содержащий инвертированные повторы. С ним связывается белок Rep (димер! это важно), что позволяет DSO принять крестообразную форму за счет спаривания нуклеотидов из повторов. После этого белок Rep делает одноцепочечный разрыв в DSO, соединяяся с его 5 -концом тирозином одного из мономеров.
Слайд 6
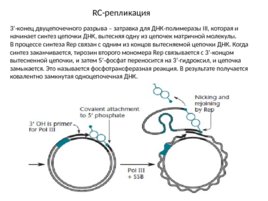
RC-репликация 3 -конец двуцепочечного разрыва – затравка для ДНК-полимеразы III, которая и начинает синтез цепочки ДНК, вытесняя одну из цепочек матричной молекулы. В процессе синтеза Rep связан с одним из концов вытесняемой цепочки ДНК. Когда синтез заканчивается, тирозин второго мономера Rep связывается с 3 -концом вытесненной цепочки, и затем 5 -фосфат переносится на 3 -гидроксил, и цепочка замыкается. Это называется фосфотрансферазная реакция. В результате получается ковалентно замкнутая одноцепочечная ДНК.
Слайд 7
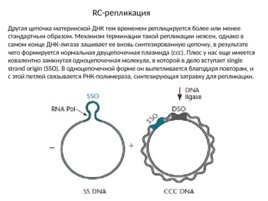
RC-репликация Другая цепочка материнской ДНК тем временем реплицируется более или менее стандартным образом. Механизм терминации такой репликации неясен, однако в самом конце ДНК-лигаза зашивает ее вновь синтезированную цепочку, в результате чего формируется нормальная двуцепочечная плазмида (ссс). Плюс у нас еще имеется ковалентно замкнутая одноцепочечная молекула, в которой в дело вступает single strand origin (SSO). В одноцепочечной форме он выпетливается благодаря повторам, и с этой петлей связывается РНК-полимераза, синтезирующая затравку для репликации.
Слайд 8
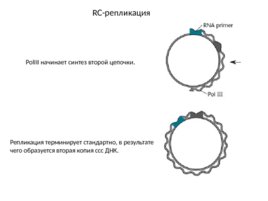
RC-репликация Pol III начинает синтез второй цепочки. Репликация терминирует стандартно, в результате чего образуется вторая копия ссс ДНК.
Слайд 9

Интересные подробности о репликации плазмид Белок Rep после своего участия в репликации «приходит в негодность» (это связано с механизмом фосфотрансферазной реакции), то есть является одноразовым. Это позволяет регулировать количество копий плазмиды внутри бактерий путем регуляции экспрессии гена rep . При этом нужно отметить, что этот ген находится на плазмидах, для репликации которых он и нужен. В некоторых плазмидах участок SSO плохо распознается РНК-полимеразой, с него не инициируется репликация. В результате этого накапливаются одноцепочечные формы плазмид. Раньше думали, что это такой отдельный вид плазмид, но на самом деле это просто «продукты недорепликации». Такие одноцепочечные молекулы либо деградируют в бактериальной клетке, либо все же РНК-полимеразе чудом удается инициировать с них репликацию.
Слайд 10

Репликация линейных плазмид В линейных плазмидах почти всегда на концах имеются шпилечные структуры. Репликация начинается в центре молекулы и идет в двух направлениях.
Слайд 11
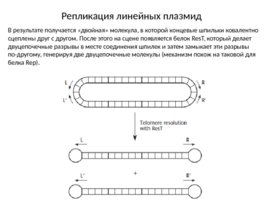
Репликация линейных плазмид В результате получается «двойная» молекула, в которой концевые шпильки ковалентно сцеплены друг с другом. После этого на сцене появляется белок Res T, который делает двуцепочечные разрывы в месте соединения шпилек и затем замыкает эти разрывы по-другому, генерируя две двуцепочечные молекулы (механизм похож на таковой для белка Rep).
Слайд 12

Несовместимость плазмид Несовместимость (inc, incompatibility) двух плазмид – их неспособность существовать в одной бактериальной клетке. Иногда при попадании в клетку двух разных плазмид одна из них при клеточном делении начинает теряться чаще, чем если бы она была в клетке одна. Это и есть несовместимость. Про такие плазмиды говорят, что они принадлежат к одной группе несовместимости. Групп несовместимости существует несколько сотен. Механизмы несовместимости: - подавление репликации одной плазмиды при экспрессии генов с другой плазмиды, - Идентичные механизмы регуляции репликации двух плазмид, конкуренция за факторы регуляции и случайное преимущество одной плазмиды над другой.
Слайд 13

Регуляция репликации плазмид и числа их копий Способов такой регуляции очень много, остановимся на основных и начнем с классической плазмиды Col EI , на основе которой сконструировано огромное количество векторов для молекулярного клонирования. 6646 пар оснований ori V – ориджин репликации; p RNAI и р NAII – промоторы для синтеза RNAI и RNAII, соответственно; inc – кодирует RNA I, rop – ген белка-регулятора числа копий; bom – участок внесения одноцепочечного разрыва; cea – ген колицина Col E1; mob – кодирует некоторые элементы, необходимые для переноса плазмид из клетки в клетку (об этом позже).
Слайд 14
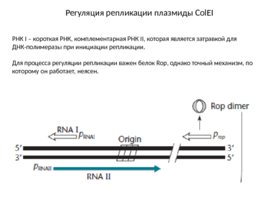
Регуляция репликации плазмиды Col EI РНК I – короткая РНК, комплементарная РНК II, которая является затравкой для ДНК-полимеразы при инициации репликации. Для процесса регуляции репликации важен белок Rop, однако точный механизм, по которому он работает, неясен.
Слайд 15
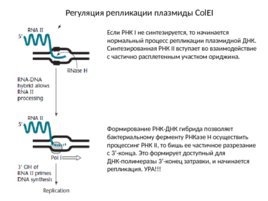
Регуляция репликации плазмиды Col EI Если РНК I не синтезируется, то начинается нормальный процесс репликации плазмидной ДНК. Синтезированная РНК II вступает во взаимодействие с частично расплетенным участком ориджина. Формирование РНК-ДНК гибрида позволяет бактериальному ферменту РНКазе Н осуществить процессинг РНК II, то бишь ее частичное разрезание с 3 -конца. Это формирует доступный для ДНК-полимеразы 3 -конец затравки, и начинается репликация. УРА!!!
Слайд 16
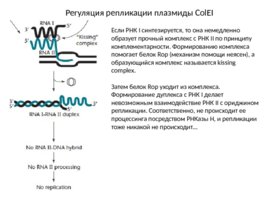
Регуляция репликации плазмиды Col EI Если РНК I синтезируется, то она немедленно образует прочный комплекс с РНК II по принципу комплементарности. Формированию комплекса помогает белок Rop (механизм помощи неясен), а образующийся комплекс называется kissing complex. Затем белок Rop уходит из комплекса. Формирование дуплекса с РНК I делает невозможным взаимодействие РНК II с ориджином репликации. Соответственно, не происходит ее процессинга посредством РНКазы Н, и репликации тоже никакой не происходит
Слайд 17

Регуляция репликации плазмиды Col EI Чем больше в клетке копий РНК I, тем слабее репликация, а значит, тем меньше копий плазмиды в дочерних клетках. Репликация полностью прекращается, если в клетке 16 копий РНК I (по одной на каждую молекулу плазмидной ДНК в норме). Дальнейшая деградация РНК I делает возможной репликацию. И все сначала То есть специальной регуляции синтеза РНК I нет, есть только поддержание естественного баланса между количеством копий этой РНК и количеством копий плазмиды. Любопытно, что «поцелуй» является довольно непрочным комплексом, и замена одного-единственного нуклеотида в РНК I делает ее совершенно неэффективной в качестве ингибитора репликации. Другое дело, что если такая мутация произошла в плазмидной ДНК, то одновременно мутировала и РНК II, они же синтезируются с одного и того же участка генома, просто с разных цепочек. А значит, их комплекс остался прочным. Однако же любая точечная мутация в этом участке плазмидной ДНК моментально формирует новую группу несовместимости! Ведь мутантная плазмида уже не будет несовместима с любой другой плазмидой с такой же последовательностью участка ориджина.
Слайд 18

Регуляция репликации плазмиды R1 Регуляция также основана на действии короткой РНК, только она образует комплекс не с затравочной РНК, а с м РНК белка Rep A, необходимого для репликации. Белок может синтезироваться в результате двух промоторов – Pcop B и Prep A. Он нужен для расплетания цепочек ДНК в районе ориджина, без него репликация не идет. Как только плазмида попадает в дочернюю клетку, Rep A синтезируется с обоих промоторов, репликация идет, все в порядке. Однако с промотора Pcop B синтезируется еще и белок Cop B, подавляющий промотор Prep A. Соответственно, через короткий промежуток времени (за который, тем не менее, плазмида успевает достичь нормального числа копий) синтез белка Rep A становится возможен только с промотора Pcop B.
Слайд 19
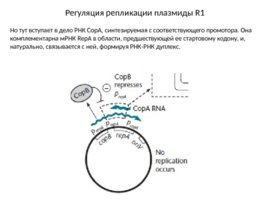
Регуляция репликации плазмиды R1 Но тут вступает в дело РНК Сор А, синтезируемая с соответствующего промотора. Она комплементарна м РНК Rep A в области, предшествующей ее стартовому кодону, и, натурально, связывается с ней, формируя РНК-РНК дуплекс.
Слайд 20

Регуляция репликации плазмиды R1 Это очень не по нраву клеточной РНКазе III, которая разрезает этот дуплекс. При этом разрезается не та часть м РНК, которая кодирует Rep A. Эта м РНК кодирует еще и так называемый лидерный полипептид, вся функция которого заключается в том, чтобы быть синтезированным. Рибосома может синтезировать Rep A только если она синтезировала лидер и «проскользила» по м РНК дальше до стартового кодона Rep A. В случае разрезания м РНК в участке лидера его синтез становится невозможным, а значит, не синтезируется и Rep A. Значит, и репликация не идет. Количество РНК Сор А зависит от количества плазмиды в клетке. Когда последнее уменьшается, уменьшается и первое. Это разрешает репликацию плазмиды, но при этом опять синтезируется РНК Сор А и репликация опять останавливается. Таким образом, количество плазмиды R1 всегда поддерживается на определенном уровне.
Слайд 21
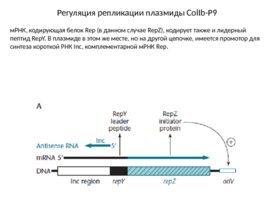
Регуляция репликации плазмиды Col Ib-P9 м РНК, кодирующая белок Rep (в данном случае Rep Z), кодирует также и лидерный пептид Rep Y. В плазмиде в этом же месте, но на другой цепочке, имеется промотор для синтеза короткой РНК Inc, комплементарной м РНК Rep.
Слайд 22
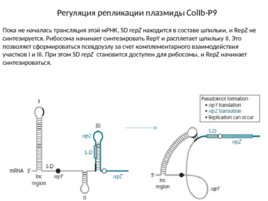
Регуляция репликации плазмиды Col Ib-P9 Пока не началась трансляция этой м РНК, SD rep Z находится в составе шпильки, и Rep Z не синтезируется. Рибосома начинает синтезировать Rep Y и расплетает шпильку II. Это позволяет сформироваться псевдоузлу за счет комплементарного взаимодействия участков I и III. При этом SD rep Z становится доступен для рибосомы, и Rep Z начинает синтезироваться.
Слайд 23
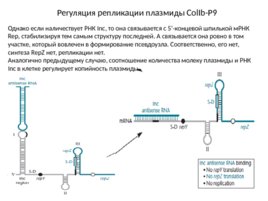
Регуляция репликации плазмиды Col Ib-P9 Однако если наличествует РНК Inc, то она связывается с 5 -концевой шпилькой м РНК Rep, стабилизируя тем самым структуру последней. А связывается она ровно в том участке, который вовлечен в формирование псевдоузла. Соответственно, его нет, синтеза Rep Z нет, репликации нет. Аналогично предыдущему случаю, соотношение количества молеку плазмиды и РНК Inc в клетке регулирует копийность плазмиды.
Слайд 24
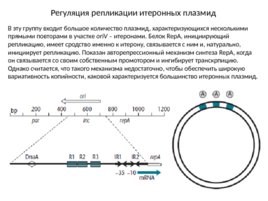
Регуляция репликации итеронных плазмид В эту группу входит большое количество плазмид, характеризующихся несколькими прямыми повторами в участке ori V – итеронами. Белок Rep A, инициирующий репликацию, имеет сродство именно к итерону, связывается с ним и, натурально, инициирует репликацию. Показан авторепрессионный механизм синтеза Rep A, когда он связывается со своим собственным промотором и ингибирует транскрпицию. Однако считается, что такого механизма недостаточно, чтобы обеспечить широкую вариативность копийности, каковой характеризуется большинство итеронных плазмид.
Слайд 25
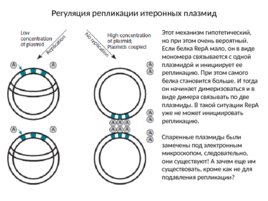
Регуляция репликации итеронных плазмид Этот механизм гипотетический, но при этом очень вероятный. Если белка Rep A мало, он в виде мономера связывается с одной плазмидой и инициирует ее репликацию. При этом самого белка становится больше. И тогда он начинает димеризоваться и в виде димера связывать по две плазмиды. В такой ситуации Rep A уже не может инициировать репликацию. Спаренные плазмиды были замечены под электронным микроскопом, следовательно, они существуют! А зачем еще им существовать, кроме как не для подавления репликации?
Слайд 26

Потеря плазмиды Потеря плазмиды есть ситуация, в которой после клеточного деления в одну из дочерних клеток не передалось ни одной копии плазмиды. Такая ситуация довольно часта, и у плазмид имеются специальные механизмы предотвращения подобных ситуаций. Одна из причин потерь плазмид – их мультимеризация. Часто бывает так, что две молекулы плазмиды в результате гомологической рекомбинации между ними (или в результате нарушений RC-репликации) формируют димерную кольцевую молекулу. Иногда в состав таких молекул входит больше двух плазмид. Это, натурально, приводит к уменьшению количества копий плазмид и к их потере. Механизмы разрешения мультимерных плазмид обратно в мономеры могут быть закодированы как в самих плазмидах, так и в хромосомной ДНК бактерий и почти всегда представляют собой различные варианты гомологической рекомбинации, о которой мы поговорим в свое время.
Слайд 27
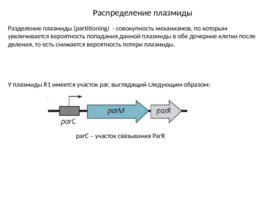
Распределение плазмиды Разделение плазмиды (partitioning) - совокупность механизмов, по которым увеличивается вероятность попадания данной плазмиды в обе дочерние клетки после деления, то есть снижается вероятность потери плазмиды. У плазмиды R1 имеется участок par, выглядящий следующим образом: par C – участок связывания Par R
Слайд 28
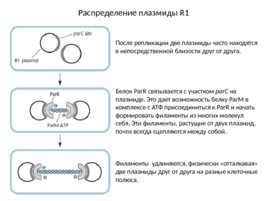
Распределение плазмиды R1 После репликации две плазмиды часто находятся в непосредственной близости друг от друга. Белок Par R связывается с участком par С на плазмиде. Это дает возможность белку Par M в комплексе с АТФ присоединиться к Par R и начать формировать филаменты из многих молекул себя. Эти филаменты, растущие от двух плазмид, почти всегда сцепляются между собой. Филаменты удлиняются, физически «отталкавая» две плазмиды друг от друга на разные клеточные полюса.
Слайд 29
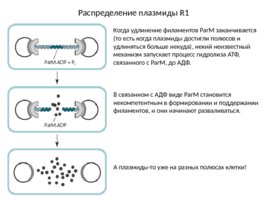
Распределение плазмиды R1 Когда удлинение филаментов Par M заканчивается (то есть когда плазмиды достигли полюсов и удлиняться больше некуда), некий неизвестный механизм запускает процесс гидролиза АТФ, связанного с Par M, до АДФ. В связанном с АДФ виде Par M становится некомпетентным в формировании и поддержании филаментов, и они начинают разваливаться. А плазмиды-то уже на разных полюсах клетки!
Слайд 30
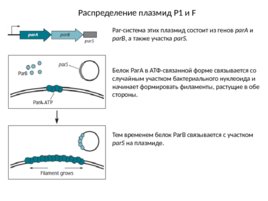
Распределение плазмид Р1 и F Par-система этих плазмид состоит из генов par A и par B , а также участка рar S. Белок Par A в АТФ-связанной форме связывается со случайным участком бактериального нуклеоида и начинает формировать филаменты, растущие в обе стороны. Тем временем белок Par B связывается с участком рar S на плазмиде.
Слайд 31
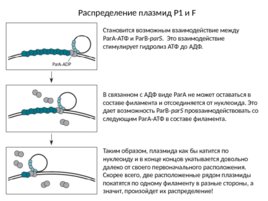
Распределение плазмид Р1 и F Становится возможным взаимодействие между Par A-АТФ и Par B- par S . Это взаимодействие стимулирует гидролиз АТФ до АДФ. В связанном с АДФ виде Par A не может оставаться в составе филамента и отсоединяется от нуклеоида. Это дает возможность Par B- par S провзаимодействовать со следующим Par A-АТФ в составе филамента. Таким образом, плазмида как бы катится по нуклеоиду и в конце концов укатывается довольно далеко от своего первоначального расположения. Скорее всего, две расположенные рядом плазмиды покатятся по одному филаменту в разные стороны, а значит, произойдет их распределение!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







