Презентация - Конъюгация
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 98%
- Слайдов: 27
- Просмотров: 4531
- Скачиваний: 1122
- Размер: 1.22 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1
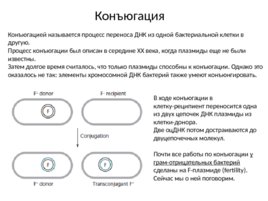
Конъюгация Конъюгацией называется процесс переноса ДНК из одной бактериальной клетки в другую. Процесс конъюгации был описан в середине ХХ века, когда плазмиды еще не были известны. Затем долгое время считалось, что только плазмиды способны к конъюгации. Однако это оказалось не так: элементы хромосомной ДНК бактерий также умеют конъюнгировать. В ходе конъюгации в клетку-реципиент переносится одна из двух цепочек ДНК плазмиды из клетки-донора. Две оц ДНК потом достраиваются до двуцепочечных молекул. Почти все работы по конъюгации у грам-отрицательных бактерий сделаны на F-плазмиде (fertility). Сейчас мы о ней поговорим.
Слайд 2
F-плазмида F-плазмида кодирует все белки, необходимые для конъюгации. Также имеются: ориджин для тета-репликации, второй ориджин (слабый) и третий, неактивный, в который внедрился Tn1000, система Par, cистемы, убивающие бактериальную клетку, если в ней нет F-плазмиды, система, блокирующая развитие бактериофага Т7, система, блокирующая хозяйскую SOS-репарацию, что сильно облегчает существование плазмиды внутри бактерии. Функции многих генов неизвестны до сих пор.
Слайд 3
Гены tra F-плазмиды Dtr-гены, или Dtr-компоненты ( DNA Transfer and Replication ). Необходимы для процессинга плазмиды при подготовке ее к конъюгациии. Mpf-гены, или Mpf-компоненты ( Mating Pair Formation ). Продукты экспрессии этих генов формируют сложный комплекс, ассоциированный с бактериальными мембранами, способствующий ассоциации двух бактериальных клеток. Через него, собственно, и происходит перенос плазмиды из клетки в клетку.
Слайд 4
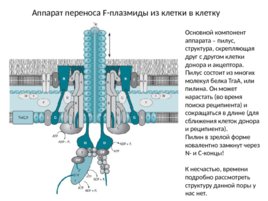
Аппарат переноса F-плазмиды из клетки в клетку Основной компонент аппарата – пилус, структура, скрепляющая друг с другом клетки донора и акцептора. Пилус состоит из многих молекул белка Tra A, или пилина. Он может нарастать (во время поиска реципиента) и сокращаться в длине (для сближения клеток донора и реципиента). Пилин в зрелой форме ковалентно замкнут через N- и С-концы! К несчастью, времени подробно рассмотреть структуру данной поры у нас нет.
Слайд 5
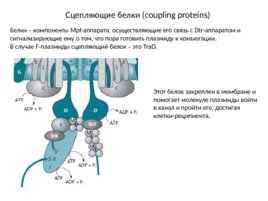
Сцепляющие белки (coupling proteins) Белки – компоненты Mpf-аппарата, осуществляющие его связь с Dtr-аппаратом и сигнализирующие ему о том, что пора готовить плазмиду к конъюгации. В случае F-плазмиды сцепляющий белок – это Tra D. Этот белок закреплен в мембране и помогает молекуле плазмиды войти в канал и пройти его, достигая клетки-реципиента.
Слайд 6
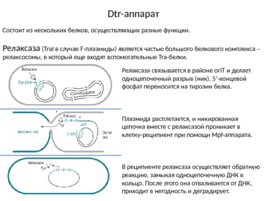
Dtr-аппарат Состоит из нескольких белков, осуществляющих разные функции. Релаксаза (Tra I в случае F-плазмиды) является частью большого белкового комплекса – релаксосомы, в который еще входят вспомогательные Tra-белки. Релаксаза связывается в районе ori T и делает одноцепочечный разрыв (ник). 5 -концевой фосфат переносится на тирозин белка. Плазмида расплетается, и никированная цепочка вместе с релаксазой проникает в клетку-реципиент при помощи Mpf-аппарата. В реципиенте релаксаза осуществляет обратную реакцию, замыкая одноцепочечную ДНК в кольцо. После этого она отваливается от ДНК, приходит в негодность и деградирует.
Слайд 7
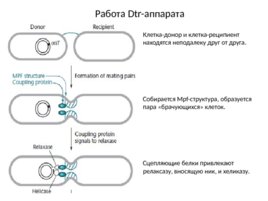
Работа Dtr-аппарата Клетка-донор и клетка-реципиент находятся неподалеку друг от друга. Собирается Mpf-структура, образуется пара «брачующихся» клеток. Сцепляющие белки привлекают релаксазу, вносящую ник, и хеликазу.
Слайд 8
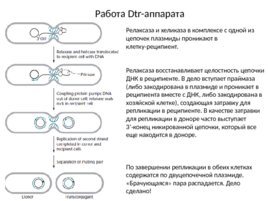
Работа Dtr-аппарата Релаксаза и хеликаза в комплексе с одной из цепочек плазмиды проникают в клетку-реципиент. Релаксаза восстанавливает целостность цепочки ДНК в реципиенте. В дело вступает праймаза (либо закодирована в плазмиде и проникает в реципиента вместе с ДНК, либо закодирована в хозяйской клетке), создающая затравку для репликации в реципиенте. В качестве затравки для репликации в доноре часто выступает 3 -конец никированной цепочки, который все еще находится в доноре. По завершении репликации в обеих клетках содержатся по двуцепочечной плазмиде. «Брачующаяся» пара распадается. Дело сделано!
Слайд 9

Регуляция конъюгации Процесс конъюгации обычно эффективен только в первое время после того, как плазмида попала в клетку-донор. Это связано с тем, что большую часть времени экспрессия большинства генов Tra подавлена. Механизмов подавления много, мы рассмотрим только нашу любимую F-плазмиду. Практически сразу после ori T в плазмидной ДНК начинаются гены Tra. Как только плазмида попала в клетку и достроилась, все экспрессируется. В том числе, и ген tra J , кодирующий транскрипционный активатор промотора Ptra Y, c которого экспрессируются все гены, необходимые для формирования пилуса. Причем эта экспрессия возможна даже пока еще плазмида находится в одноцепочечной форме.
Слайд 10
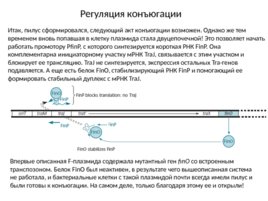
Регуляция конъюгации Итак, пилус сформировался, следующий акт конъюгации возможен. Однако же тем временем вновь попавшая в клетку плазмида стала двуцепочечной! Это позволяет начать работать промотору Pfin P, с которого синтезируется короткая РНК Fin P. Она комплементарна инициаторному участку м РНК Tra J, связывается с этим участком и блокирует ее трансляцию. Tra J не синтезируется, экспрессия остальных Tra-генов подавляется. А еще есть белок Fin O, стабилизирующий РНК Fin P и помогающий ее формировать стабильный дуплекс с м РНК Tra J. Впервые описанная F-плазмида содержала мутантный ген fin O со встроенным транспозоном. Белок Fin O был неактивен, в результате чего вышеописанная система не работала, и бактериальные клетки с такой плазмидой почти всегда имели пилус и были готовы к конъюгации. На самом деле, только благодаря этому ее и открыли!
Слайд 11

Бактериальный промискуитет Перенос плазмиды из бактерию в бактерию другого вида – рядовое событие. Существует класс плазмид, которые называются плазмидами промискуитета. Они в норме присутствуют в клетках E.coli и могут легко переноситься в любые грам-отрицательные бактерии, а с невысокой частотой – в цианобактерии, грам-положительные бактерии и даже в клетки высших растений! Обыкновенная F-плазмида при определенных условиях может перейти из клетки E.coli в клетку пекарских дрожжей. Плазмиды промискуитета играют важную роль в эволюции, а также являются одной из основных причин быстрого распространения устойчивости к антибиотикам среди бактерий.
Слайд 12
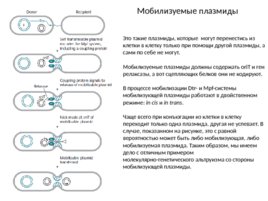
Мобилизуемые плазмиды Это такие плазмиды, которые могут перенестись из клетки в клетку только при помощи другой плазмиды, а сами по себе не могут. Мобилизуемые плазмиды должны содержать ori T и ген релаксазы, а вот сцепляющих белков они не кодируют. В процессе мобилизации Dtr- и Mpf-системы мобилизующей плазмиды работают в двойственном режиме: in cis и in trans . Чаще всего при конъюгации из клетки в клетку переходит только одна плазмида, другая не успевает. В случае, показанном на рисунке, это с равной вероятностью может быть либо мобилизующая, либо мобилизуемая плазмида. Таким образом, мы имеем дело с отличным примером молекулярно-генетического альтруизма со стороны мобилизующей плазмиды.
Слайд 13
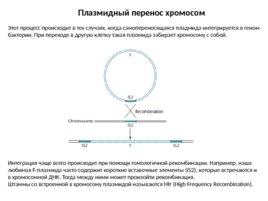
Плазмидный перенос хромосом Этот процесс происходит в тех случаях, когда самопереносящаяся пладмида интегрируется в геном бактерии. При переходе в другую клетку такая плазмида забирает хромосому с собой. Интеграция чаще всего происходит при помощи гомологичной рекомбинации. Например, наша любимая F-плазмида часто содержит короткие вставочные элементы (IS2), которые встречаются и в хромосомной ДНК. Тогда между ними может произойти рекомбинация. Штаммы со встроенной в хромосому плазмидой называются Hfr (High Frequency Recombination).
Слайд 14
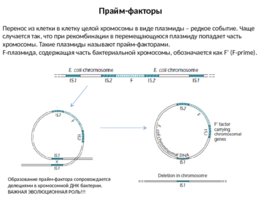
Прайм-факторы Перенос из клетки в клетку целой хромосомы в виде плазмиды – редкое событие. Чаще случается так, что при рекомбинации в перемещающуюся плазмиду попадает часть хромосомы. Такие плазмиды называют прайм-факторами. F-плазмида, содержащая часть бактериальной хромосомы, обозначается как F (F-prime). Образование прайм-фактора сопровождается делециями в хромосомной ДНК бактерии. ВАЖНАЯ ЭВОЛЮЦИОННАЯ РОЛЬ!!!
Слайд 15
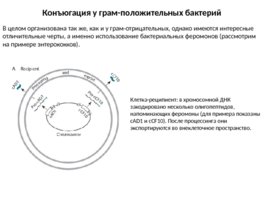
Конъюгация у грам-положительных бактерий В целом организована так же, как и у грам-отрицательных, однако имеются интересные отличительные черты, а именно использование бактериальных феромонов (рассмотрим на примере энтерококков). Клетка-реципиент: в хромосомной ДНК закодировано несколько олигопептидов, напоминающих феромоны (для примера показаны c AD1 и c CF10). После процессинга они экспортируются во внеклеточное пространство.
Слайд 16
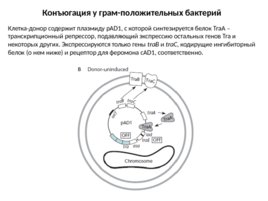
Конъюгация у грам-положительных бактерий Клетка-донор содержит плазмиду p AD1, с которой синтезируется белок Tra A – транскрипционный репрессор, подавляющий экспрессию остальных генов Tra и некоторых других. Экспрессируются только гены tra B и tra C , кодирущие ингибиторный белок (о нем ниже) и рецептор для феромона с AD1, соответственно.
Слайд 17
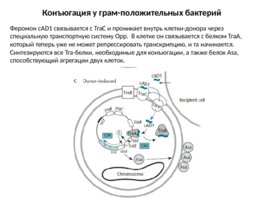
Конъюгация у грам-положительных бактерий Феромон c AD1 связывается с Tra C и проникает внутрь клетки-донора через специальную транспортную систему Opp. В клетке он связывается с белком Tra A, который теперь уже не может репрессировать транскрипцию, и та начинается. Синтезируются все Tra-белки, необходимые для конъюгации, а также белок Asa, способствующий агрегации двух клеток.
Слайд 18
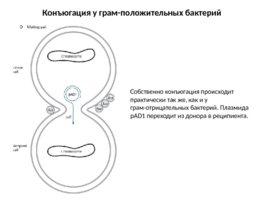
Конъюгация у грам-положительных бактерий Собственно конъюгация происходит практически так же, как и у грам-отрицательных бактерий. Плазмида p AD1 переходит из донора в реципиента.
Слайд 19
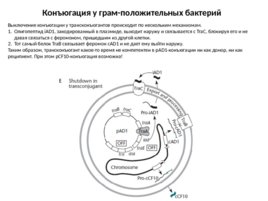
Конъюгация у грам-положительных бактерий Выключение конъюгации у трансконъюгантов происходит по нескольким механизмам. Олигопептид i AD1, закодированный в плазмиде, выходит наружу и связывается с Tra C, блокируя его и не давая связаться с феромоном, пришедшим из другой клетки. Тот самый белок Tra B связывает феромон c AD1 и не дает ему выйти наружу. Таким образом, трансконъюгант какое-то время не компетентен в p AD1-конъюгации ни как донор, ни как реципиент. При этом p CF10-конъюгация возможна!
Слайд 20
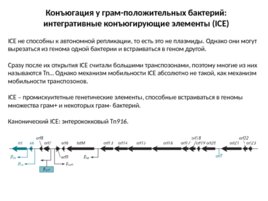
Конъюгация у грам-положительных бактерий: интегративные конъюгирующие элементы (ICE) ICE не способны к автономной репликации, то есть это не плазмиды. Однако они могут вырезаться из генома одной бактерии и встраиваться в геном другой. Сразу после их открытия ICE считали большими транспозонами, поэтому многие из них называются Tn Однако механизм мобильности ICE абсолютно не такой, как механизм мобильности транспозонов. ICE – промискуитетные генетические элементы, способные встраиваться в геномы множества грам и некоторых грам- бактерий. Канонический ICE: энтерококковый Tn 916 .
Слайд 21
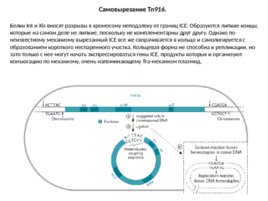
Самовырезание Tn 916 . Белки Int и Xis вносят разрывы в хромосому неподалеку от границ ICE. Образуются липкие концы, которые на самом деле не липкие, поскольку не комплементарны друг другу. Однако по неизвестному механизму вырезанный ICE все же сворачивается в кольцо и самолигируется с образованием короткого неспаренного участка. Кольцевая форма не способна к репликации, но зато только с нее могут начать экспрессироваться гены ICE, продукты которых и организуют конъюгацию по механизму, очень напоминающему Tra-механизм плазмид.
Слайд 22

Самовстраивание Tn 916 . Перед конъюгацией кольцевой ICE никируется, и одна цепочка ICE проникает в реципиента. Там на ее матрице достраивается вторая цепочка, и двуцепочечный ICE снова самолигируется. Наконец, белок Int встраивает ICE в хромосому реципиента по механизму, очень напоминающему таковой у бактериофагов (о нем мы поговорим позднее).
Слайд 23
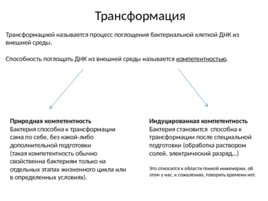
Трансформация Трансформацией называется процесс поглощения бактериальной клеткой ДНК из внешней среды. Способность поглощать ДНК из внешней среды называется компетентностью . Природная компетентность Бактерия способна к трансформации сама по себе, без какой-либо дополнительной подготовки (такая компетентность обычно свойственна бактериям только на отдельных этапах жизненного цикла или в определенных условиях). Индуцированная компетентность Бактерия становится способна к трансформации после специальной подготовки (обработка раствором солей, электрический разряд ) Это относится к области генной инженерии, об этом у нас, к сожалению, говорить времени нет.
Слайд 24
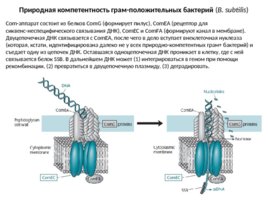
Природная компетентность грам-положительных бактерий ( B. subtilis ) Com-аппарат состоит из белков Com G (формирует пилус), Com EA (рецептор для сиквенс-неспецифического связывания ДНК), Com EC и Com FА (формируют канал в мембране). Двуцепочечная ДНК связывается с Com EA, после чего в дело вступает внеклеточная нуклеаза (которая, кстати, идентифицирована далеко не у всех природно-компетентных грам бактерий) и съедает одну из цепочек ДНК. Оставшаяся одноцепочечная ДНК проникает в клетку, где с ней связывается белок SSB. В дальнейшем ДНК может (1) интегрироваться в геном при помощи рекомбинации, (2) превратиться в двуцепочечную плазмиду, (3) деградировать.
Слайд 25
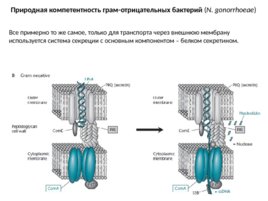
Природная компетентность грам-отрицательных бактерий ( N. gonorrhoeae ) Все примерно то же самое, только для транспорта через внешнюю мембрану используется система секреции с основным компонентом – белком секретином.
Слайд 26
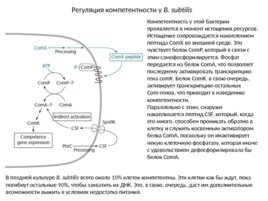
Регуляция компетентности у B. subtilis Компетентность у этой бактерии проявляется в момент истощения ресурсов. Истощение сопровождается накоплением пептида Com X во внешней среде. Это чувствует белок Com Р, который в связи с этим самофосфорилируется. Фосфат передается на белок Com A, что позволяет последнему активировать транскрипцию гена com K . Белок Com K, в свою очередь, активирует транскрипцию остальных Com-генов, что приводит к наведению компетентности. Параллельно с этим, снаружи накапливается пептид CSF, который, когда его много, способен проникать обратно в клетку и служить косвенным активатором белка Com A, поскольку он инактивирует некую клеточную фосфатазу, которая иначе с удовольствием дефосфорилировала бы белок Com A. В поздней культуре B. subtilis всего около 10% клеток компетентны. Эти клетки как бы ждут, пока погибнут остальные 90%, чтобы захватить их ДНК. Это, в свою, очередь, даст им дополнительные возможности выжить в условиях недостатка питания.
Слайд 27
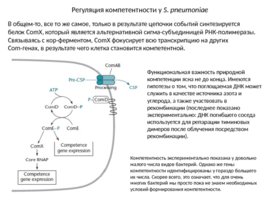
Регуляция компетентности у S. pneumoniae В общем-то, все то же самое, только в результате цепочки событий синтезируется белок Com X, который является альтернативной сигма-субъединицей РНК-полимеразы. Связываясь с кор-ферментом, Com X фокусирует всю транскрипцию на других Com-генах, в результате чего клетка становится компетентной. Компетентность экспериментально показана у довольно малого числа видов бактерий. Однако же гены компетентности идентифицированы у гораздо большего их числа. Скорее всего, это означает, что для очень многих бактерий мы просто пока не знаем необходимых условий формирования компетентности. Функциональная важность природной компетенции ясна не до конца. Имеются гипотезы о том, что поглощаемая ДНК может служить в качестве источника азота и углерода, а также участвовать в рекомбинации (последнее показано экспериментально: ДНК погибшего соседа используется для репарации тиминовых димеров после облучения посредством рекомбинации).
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







