Презентация - Сравнительная характеристика галогенов
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 93%
- Слайдов: 22
- Просмотров: 5636
- Скачиваний: 2485
- Размер: 1.11 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Сравнительная характеристика героев
Сравнительная характеристика героев Сравнительная характеристика биографий А.С. Пушкина и М.Ю. Лермонтова
Сравнительная характеристика биографий А.С. Пушкина и М.Ю. Лермонтова Группы растений: сравнительная характеристика отделов, классов и семейств высших растений
Группы растений: сравнительная характеристика отделов, классов и семейств высших растений Группы растений сравнительная характеристика отделов, классов и семейств высших растений
Группы растений сравнительная характеристика отделов, классов и семейств высших растений Социально-экономическая характеристика Липецкой области
Социально-экономическая характеристика Липецкой области Моря, их характеристики (4 класс)
Моря, их характеристики (4 класс) Дальний восток. Характеристика района
Дальний восток. Характеристика района
Слайды и текст этой онлайн презентации
Слайд 1

Сравнительная характеристика галогенов
Слайд 2
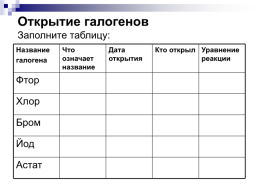
Открытие галогенов Заполните таблицу:
Название галогена.Что означает название.Дата открытия.Кто открыл.Уравнение реакции
Фтор....
Хлор....
Бром....
Йод....
Астат....
Название галогена.Что означает название.Дата открытия.Кто открыл.Уравнение реакции
Фтор....
Хлор....
Бром....
Йод....
Астат....
Слайд 3

Открытие фтора
Фтор(F2) –от греч. «фторос»- разрушающий был открыт в 1866 году французским химиком Анри Муассаном электролизом смеси жидкого безводного HF и гидродифторида калия KHF2 в платиновом сосуде: 2HF→H2↑ + F2↑ катод анод В 1906 году Муассан был удостоен Нобелевской премии за открытие элемента фтора и введение в практику электрической печи, названной его именем
Слайд 4

Открытие хлора
Хлор Cl2 от греч. «хлорос» - желто-зеленый 1774 год Шведский аптекарь Карл Вильгельм Шееле «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах». Уравнение реакции: MnO2+ 4HCl Cl2+ MnCl2 + 2H2O
Слайд 5

Открытие брома
Бром (Br2) от греч. «бромос»- зловонный Был открыт в 1826 году Французским химиком (24-летним лаборантом) Антуаном- Жеромом Баларом Действием хлором на рассолы соляных болот Франции по реакции: 2NaBr + Cl2 → 2NaCl + Br2
Бром (Br2) от греч. «бромос»- зловонный Был открыт в 1826 году Французским химиком (24-летним лаборантом) Антуаном- Жеромом Баларом Действием хлором на рассолы соляных болот Франции по реакции: 2NaBr + Cl2 → 2NaCl + Br2
Слайд 6

Открытие йода
Йод (I2) от греч. «иодес» - фиолетовый Был открыт в 1811 году Французским химиком-технологом и фармацевтом Бернаром Куртуа в золе морских водорослей Уравнение реакции: 2NaI + H2SO4 → Na2SO4 + I2
Йод (I2) от греч. «иодес» - фиолетовый Был открыт в 1811 году Французским химиком-технологом и фармацевтом Бернаром Куртуа в золе морских водорослей Уравнение реакции: 2NaI + H2SO4 → Na2SO4 + I2
Слайд 7

Открытие астата
Астат(At2) от греч. «астатос» - неустойчивый Был получен в 1940 году Искусственным путем при облучении висмута альфа-частицами Учеными Калифорнийского университета Д.Корсоном и К.Р.Маккензи
Астат(At2) от греч. «астатос» - неустойчивый Был получен в 1940 году Искусственным путем при облучении висмута альфа-частицами Учеными Калифорнийского университета Д.Корсоном и К.Р.Маккензи
Слайд 8

Строение атомов галогенов
Заряд ядра увеличивается Радиус атома увеличивается Количество валентных электронов равно 7 Притяжение валентных электронов к ядру уменьшается Способность отдавать электроны увеличивается Неметаллические свойства ослабевают Окислительная способность уменьшается
F+9 ) ) 2 7 Cl+17 ) ) ) 2 8 7 Br+35 ) ) ) ) 2 8 18 7 l +53 ) ) ) ) ) 2 8 18 18 7
Заряд ядра увеличивается Радиус атома увеличивается Количество валентных электронов равно 7 Притяжение валентных электронов к ядру уменьшается Способность отдавать электроны увеличивается Неметаллические свойства ослабевают Окислительная способность уменьшается
F+9 ) ) 2 7 Cl+17 ) ) ) 2 8 7 Br+35 ) ) ) ) 2 8 18 7 l +53 ) ) ) ) ) 2 8 18 18 7
Слайд 9

Физические свойства простых веществ-галогенов
Хлор
Бром
Астат
Йод
Хлор
Бром
Астат
Йод
Слайд 10

Возгонка йода
Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое (возгонка),превращаясь в фиолетовые пары.
Пары йода
Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое (возгонка),превращаясь в фиолетовые пары.
Пары йода
Слайд 11
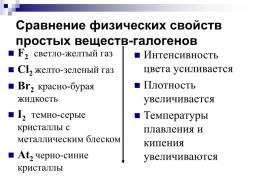
Сравнение физических свойств простых веществ-галогенов
F2 светло-желтый газ Cl2 желто-зеленый газ Br2 красно-бурая жидкость I2 темно-серые кристаллы с металлическим блеском At2 черно-синие кристаллы
Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются
F2 светло-желтый газ Cl2 желто-зеленый газ Br2 красно-бурая жидкость I2 темно-серые кристаллы с металлическим блеском At2 черно-синие кристаллы
Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются
Слайд 12

Химические свойства фтора
Взаимодействует со всеми металлами с выделением большого количества теплоты: с алюминием: 3F2 + 2 Al→ 2 AlF3 + 2989 кДж с железом : 3F2 + 2Fe → 2FeF3 + 1974 кДж При нагревании взаимодействует со многими неметаллами, кроме кислорода, азота и алмаза с водородом: F2 + H2 → 2HF2 +547 кДж c кремнием: 2F2 + Si → SiF4 + 1615 кДж Окисляет другие галогены: хлор: F2 + Cl2 → 2ClF бром: F2 + Br2 → 2BrF йод: F2 + I2 → 2lF
Взаимодействует со всеми металлами с выделением большого количества теплоты: с алюминием: 3F2 + 2 Al→ 2 AlF3 + 2989 кДж с железом : 3F2 + 2Fe → 2FeF3 + 1974 кДж При нагревании взаимодействует со многими неметаллами, кроме кислорода, азота и алмаза с водородом: F2 + H2 → 2HF2 +547 кДж c кремнием: 2F2 + Si → SiF4 + 1615 кДж Окисляет другие галогены: хлор: F2 + Cl2 → 2ClF бром: F2 + Br2 → 2BrF йод: F2 + I2 → 2lF
Слайд 13

Химические свойства фтора
Реагирует при облучении даже с инертными газами Xe + F2 → Xe F2 + 152 кДж Взаимодействует со сложными веществами: с водой: 2F2 + 2H2O → 4HF + O2↑ cо щелочами: 2F2 + 2NaOH → 2NaF + H2O + OF2 ↑ с оксидом кремния: 2F2 + SiO2 → SiF4 + O2↑
Реагирует при облучении даже с инертными газами Xe + F2 → Xe F2 + 152 кДж Взаимодействует со сложными веществами: с водой: 2F2 + 2H2O → 4HF + O2↑ cо щелочами: 2F2 + 2NaOH → 2NaF + H2O + OF2 ↑ с оксидом кремния: 2F2 + SiO2 → SiF4 + O2↑
Слайд 14

Химические свойства брома
Химическая активность брома меньше, чем у фтора и хлора, но достаточно высока. С металлами: Взаимодействие брома с алюминием 3Br2 + 2Al → 2AlBr3 С неметаллами: Взаимодействие с водородом Br2 + H2 → 2 HBr Взаимодействие с кремнием 2Br2 + Si → SiBr4 При растворении брома в воде образуется бромная вода, которую используют в органической химии.
Химическая активность брома меньше, чем у фтора и хлора, но достаточно высока. С металлами: Взаимодействие брома с алюминием 3Br2 + 2Al → 2AlBr3 С неметаллами: Взаимодействие с водородом Br2 + H2 → 2 HBr Взаимодействие с кремнием 2Br2 + Si → SiBr4 При растворении брома в воде образуется бромная вода, которую используют в органической химии.
Слайд 15

Химические свойства йода
Химическая активность йода еще ниже, чем у брома. С металлами только при нагревании: Взаимодействие йода с железом I2 + Fe → FeI2 Взаимодействие йода с алюминием 3I2 + 2Al → 2AlI3 С неметаллами: Взаимодействует с водородом при нагревани I2 + H2 → 2 HI - Q
Химическая активность йода еще ниже, чем у брома. С металлами только при нагревании: Взаимодействие йода с железом I2 + Fe → FeI2 Взаимодействие йода с алюминием 3I2 + 2Al → 2AlI3 С неметаллами: Взаимодействует с водородом при нагревани I2 + H2 → 2 HI - Q
Слайд 16

Вывод:
химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может вытеснять галоген с большим порядковым номером из его соединений с водородом и металлами: Взаимодействие хлорной воды с галогенидами 2KI + Cl2 → 2KCl + I2 NaCl + Cl2 → 2NaBr + Cl2 → 2NaCl + Br2
химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может вытеснять галоген с большим порядковым номером из его соединений с водородом и металлами: Взаимодействие хлорной воды с галогенидами 2KI + Cl2 → 2KCl + I2 NaCl + Cl2 → 2NaBr + Cl2 → 2NaCl + Br2
Слайд 17

Качественные реакции на галогенид-ионы
Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl + AgNO3 → AgCl↓ + NaNO3 белый творожистый осадок NaBr + AgNO3 → AgBr↓ + NaNO3 желтоватый творожистый осадок NaI + AgNO3 → AgI↓ + NaNO3 желтый творожистый осадок
Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl + AgNO3 → AgCl↓ + NaNO3 белый творожистый осадок NaBr + AgNO3 → AgBr↓ + NaNO3 желтоватый творожистый осадок NaI + AgNO3 → AgI↓ + NaNO3 желтый творожистый осадок
Слайд 18

Галогены и здоровье
Заполни таблицу:
Название галогена.Роль в организме.Недостаток.Избыток.Источник
....
Заполни таблицу:
Название галогена.Роль в организме.Недостаток.Избыток.Источник
....
Слайд 19
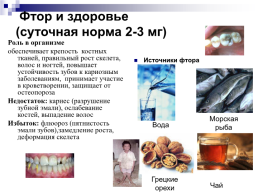
Фтор и здоровье (суточная норма 2-3 мг)
Роль в организме обеспечивает крепость костных тканей, правильный рост скелета, волос и ногтей, повышает устойчивость зубов к кариозным заболеваниям, принимает участие в кроветворении, защищает от остеопороза Недостаток: кариес (разрушение зубной эмали), ослабевание костей, выпадение волос Избыток: флюороз (пятнистость эмали зубов),замедление роста, деформация скелета
Источники фтора
Морская рыба
Вода
Грецкие орехи
Чай
Роль в организме обеспечивает крепость костных тканей, правильный рост скелета, волос и ногтей, повышает устойчивость зубов к кариозным заболеваниям, принимает участие в кроветворении, защищает от остеопороза Недостаток: кариес (разрушение зубной эмали), ослабевание костей, выпадение волос Избыток: флюороз (пятнистость эмали зубов),замедление роста, деформация скелета
Источники фтора
Морская рыба
Вода
Грецкие орехи
Чай
Слайд 20

Хлор и здоровье (суточная норма 2г)
Роль в организме: Образование соляной кислоты, поддержание водно-электролитного баланса, выведение шлаков и углекислого газа из организма, расщепление жиров Недостаток: мышечная слабость, сонливость, вялость, ослабление памяти, потеря аппетита, сухость во рту, выпадение зубов и волос Избыток: задержка воды в тканях, повышение кровяного давления, боли в голове и груди, диспепсические расстройства, сухой кашель, слезотечение, резь в глазах
Источники хлора
Бобовые
Свекла
Поваренная соль
Злаки
Роль в организме: Образование соляной кислоты, поддержание водно-электролитного баланса, выведение шлаков и углекислого газа из организма, расщепление жиров Недостаток: мышечная слабость, сонливость, вялость, ослабление памяти, потеря аппетита, сухость во рту, выпадение зубов и волос Избыток: задержка воды в тканях, повышение кровяного давления, боли в голове и груди, диспепсические расстройства, сухой кашель, слезотечение, резь в глазах
Источники хлора
Бобовые
Свекла
Поваренная соль
Злаки
Слайд 21

Бром и здоровье (суточная норма 0,5-2 мг)
Роль в организме: принимает участие в регуляции деятельности нервной системы, оказывает влияние на функции половых желез, влияет на процессы возбуждения и торможения в головном мозге Недостаток: бессонница, снижение уровня роста эритроцитов в крови. Избыток: кожное заболевание – бромодерма, нарушение работы нервной системы, апатия, сонливость, ослабление памяти
Источники брома
Роль в организме: принимает участие в регуляции деятельности нервной системы, оказывает влияние на функции половых желез, влияет на процессы возбуждения и торможения в головном мозге Недостаток: бессонница, снижение уровня роста эритроцитов в крови. Избыток: кожное заболевание – бромодерма, нарушение работы нервной системы, апатия, сонливость, ослабление памяти
Источники брома
Слайд 22

Йод и здоровье (суточная норма100-200 мкг)
Роль в организме: Участие в синтезе гормонов щитовидной железы, создание патрульных клеток в крови- фагоцитов. Избыток: гипертиреоз- увеличение обмена веществ учащение пульса, возбудимость Недостаток: гипотиреоз-снижение функции щитовидной железы( снижение обмена веществ, понижение температуры тела, слабость), базедова болезнь, умственная отсталость
Источники йода
Кальмары
Хурма
Томаты
Морская рыба
Морская капуста
Морковь
Роль в организме: Участие в синтезе гормонов щитовидной железы, создание патрульных клеток в крови- фагоцитов. Избыток: гипертиреоз- увеличение обмена веществ учащение пульса, возбудимость Недостаток: гипотиреоз-снижение функции щитовидной железы( снижение обмена веществ, понижение температуры тела, слабость), базедова болезнь, умственная отсталость
Источники йода
Кальмары
Хурма
Томаты
Морская рыба
Морская капуста
Морковь
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
