Слайды и текст этой онлайн презентации
Слайд 1
N A n N
m M
p V V m
Слайд 2
Тема урока
Молярный объем газов. Закон Авагадро
Слайд 3
Девиз урока
У пространства нет размера, а у знаний нет предела
Слайд 4
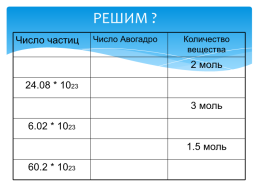
РЕШИМ ?
Число частиц.Число Авогадро.Количество вещества
..2 моль
24.08 * 1023..
..3 моль
6.02 * 1023..
..1.5 моль
60.2 * 1023..
Слайд 5
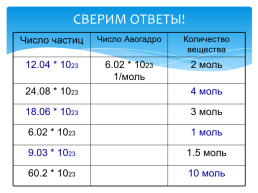
СВЕРИМ ОТВЕТЫ!
Число частиц.Число Авогадро.Количество вещества
12.04 * 1023.6.02 * 1023 1/моль.2 моль
24.08 * 1023..4 моль
18.06 * 1023..3 моль
6.02 * 1023..1 моль
9.03 * 1023..1.5 моль
60.2 * 1023..10 моль
Слайд 6
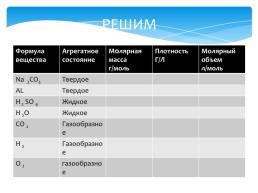
РЕШИМ
Формула вещества.Агрегатное состояние.Молярная масса
г/моль.Плотность
Г/Л.Молярный объем
л/моль
Na 2CO3.Твердое...
AL.Твердое...
H 2 SO 4.Жидкое...
Н 2О.Жидкое...
СО 2.Газообразное...
Н 2.Газообразное...
О 2.газообразное...
Слайд 7
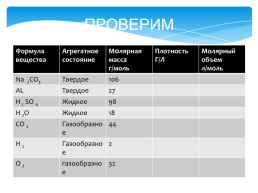
ПРОВЕРИМ
Формула вещества.Агрегатное состояние.Молярная масса
г/моль.Плотность
Г/Л.Молярный объем
л/моль
Na 2CO3.Твердое.106..
AL.Твердое.27..
H 2 SO 4.Жидкое.98..
Н 2О.Жидкое.18..
СО 2.Газообразное.44..
Н 2.Газообразное.2..
О 2.газообразное.32..
Слайд 8
Все ребята дружно встали
И на месте зашагали.
На носочках потянулись.
Как пружинки мы присели
И тихонько разом сели.
Для начала мы с тобой
Крутим только головой.
Корпусом вращаем тоже.
Это мы, конечно, сможем.
Напоследок потянулись
Вверх и в стороны.
Прогнулись.
От разминки раскраснелись
И за парты снова сели.
Слайд 9
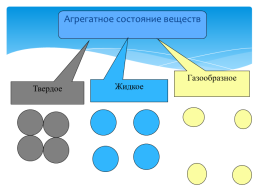
Агрегатное состояние веществ
Газообразное
Жидкое
Твердое
Слайд 10
Нормальные условия
Р = 1 атм = 760 мм рт.ст.
t = 0 Со
Слайд 11
Молярный объем газообразных веществ
При одинаковых условиях газообразные вещества количеством 1 моль занимают одинаковый объем –
22.4 л/моль.
Слайд 12
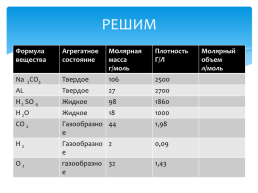
РЕШИМ
Формула вещества.Агрегатное состояние.Молярная масса
г/моль.Плотность
Г/Л.Молярный объем
л/моль
Na 2CO3.Твердое.106.2500.
AL.Твердое.27.2700.
H 2 SO 4.Жидкое.98.1860.
Н 2О.Жидкое.18.1000.
СО 2.Газообразное.44.1,98.
Н 2.Газообразное.2.0,09.
О 2.газообразное.32.1,43.
Слайд 13
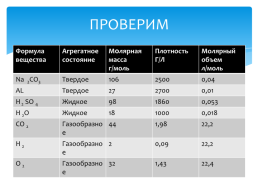
ПРОВЕРИМ
Формула вещества.Агрегатное состояние.Молярная масса
г/моль.Плотность
Г/Л.Молярный объем
л/моль
Na 2CO3.Твердое.106.2500.0,04
AL.Твердое.27.2700.0,01
H 2 SO 4.Жидкое.98.1860.0,053
Н 2О.Жидкое.18.1000.0,018
СО 2.Газообразное.44.1,98.22,2
Н 2.Газообразное.2.0,09.22,2
О 2.Газообразное.32.1,43.22,4
Слайд 14
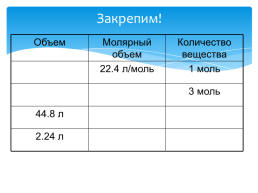
Закрепим!
Объем.Молярный объем.Количество вещества
.22.4 л/моль.1 моль
..3 моль
44.8 л..
2.24 л..
Слайд 15
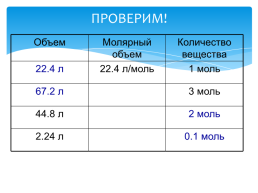
ПРОВЕРИМ!
Объем.Молярный объем.Количество вещества
22.4 л.22.4 л/моль.1 моль
67.2 л..3 моль
44.8 л..2 моль
2.24 л..0.1 моль
Слайд 17
Закон Авогадро
если N1 = N2, то V1 = V2
если брать одинаковые объемы газов при одинаковых условиях (Р и t), то они будут содержать одинаковое число молекул.
Следствие – при одинаковых условиях 1 моль любого газа занимает одинаковый объем (22,4 л/моль).
Слайд 18
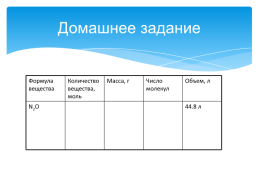
Домашнее задание
Формула вещества.Количество вещества, моль.Масса, г.Число молекул.Объем, л
N2О....44.8 л
Слайд 19
РЕФЛЕКСИЯ
сегодня я узнал...
было трудно…
я понял, что…
я научился…
я смог…
было интересно узнать, что…
меня удивило…
мне захотелось…
 Импульс тела (примеры на закон сохранения импульса)
Импульс тела (примеры на закон сохранения импульса) Закономерности и случайности в жизни народов
Закономерности и случайности в жизни народов Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы Импульс. Закон сохранения импульса
Импульс. Закон сохранения импульса Механическая энергия. Закон сохранения энергии
Механическая энергия. Закон сохранения энергии Закон на защите детства
Закон на защите детства Лабораторная работа № 8 «изучение законов сохранения зарядового и массового чисел в ядерных реакциях»
Лабораторная работа № 8 «изучение законов сохранения зарядового и массового чисел в ядерных реакциях»