Презентация - Железо
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 89%
- Слайдов: 44
- Просмотров: 6246
- Скачиваний: 2974
- Размер: 5.02 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Железо
Слайд 2

Железо: строение атома, физические и химические свойства. Генетические ряды железа (II) и железа (III).
Слайд 3

Положение элемента – железа в периодической системе Д.И. Менделеева.
Порядковый номер Период Группа Подгруппа
26 Четвертый 8 Побочная
Порядковый номер Период Группа Подгруппа
26 Четвертый 8 Побочная
Слайд 4

Строение атома железа
Допишите электронную формулу 1s2 2s2 2р6 3s2 3р6….
Допишите электронную формулу 1s2 2s2 2р6 3s2 3р6….
Слайд 5

1s2 2s2 2р6 3s2 3р6 3d6 4s2
Какие электроны для элементов главных подгрупп являются валентными? А какие электроны для элементов побочных подгрупп являются валентными? Запомни! Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.
валентные электроны
Какие электроны для элементов главных подгрупп являются валентными? А какие электроны для элементов побочных подгрупп являются валентными? Запомни! Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.
валентные электроны
Слайд 6

Запомните!
Валентные электроны атомов элементов побочных подгрупп распределяются на последнем и предпоследнем уровнях.
Валентные электроны атомов элементов побочных подгрупп распределяются на последнем и предпоследнем уровнях.
Слайд 7

Для железа характерны две основные степени окисления: +2, +3.
Fe0 –2e = Fe+2
Fe0 –3e = Fe+3
Слайд 8

Постройте электронно – графические конфигурации нормального и возбужденного состояния атома железа.
Слайд 9
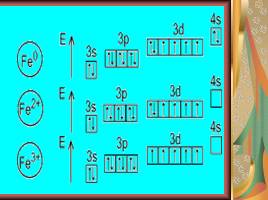
Слайд 10

Основными железными рудами являются:
магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
Слайд 11

гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
Слайд 12

лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:
Слайд 13

пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.
Слайд 14

Соединения железа:
Fe3O4 – магнитный железняк Fe2O3 – красный железняк (гематит) 2Fe2O3 * 3H2O – бурый железняк FeS2 – железный колчедан
Fe3O4 – магнитный железняк Fe2O3 – красный железняк (гематит) 2Fe2O3 * 3H2O – бурый железняк FeS2 – железный колчедан
Слайд 15

Физические свойства железа:
Цвет Блеск Пластичность Магнитные свойства Температура плавления Твердость
Серебристо-белый Блестящий Очень пластичный, легко куется, прокатывается, штампуется Намагничивается и размагничивается 15390С Твердый
Цвет Блеск Пластичность Магнитные свойства Температура плавления Твердость
Серебристо-белый Блестящий Очень пластичный, легко куется, прокатывается, штампуется Намагничивается и размагничивается 15390С Твердый
Слайд 16

Железо – металл серого цвета
Слайд 17
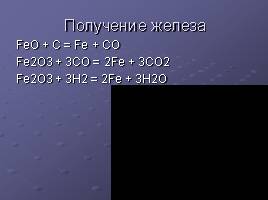
Получение железа
FeO + C = Fe + CO Fe2O3 + 3CO = 2Fe + 3CO2 Fe2O3 + 3H2 = 2Fe + 3H2O
FeO + C = Fe + CO Fe2O3 + 3CO = 2Fe + 3CO2 Fe2O3 + 3H2 = 2Fe + 3H2O
Слайд 18
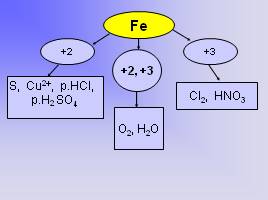
Fe
+3
+2
+2, +3
O2, H2O
CI2, HNO3
S, Cu2+, p.HCI, p.H2 SO4
+3
+2
+2, +3
O2, H2O
CI2, HNO3
S, Cu2+, p.HCI, p.H2 SO4
Слайд 19

Fe + CI2 = Fe + S = Fe + HCI = Fe + O2 = Fe + CuSO4 = Fe + H2O = Fe + O2 + H2O =
Закончить уравнения химических реакций:
Слайд 20

Химические свойства железа
Взаимодействие с простыми веществами -неметаллами 1) С кислородом. 0 0 +2, +3 -2 +2 -2 +3 -2 3Fe + 2O2 —>Fe3O4 (FeO • Fe2O3 )
Взаимодействие с простыми веществами -неметаллами 1) С кислородом. 0 0 +2, +3 -2 +2 -2 +3 -2 3Fe + 2O2 —>Fe3O4 (FeO • Fe2O3 )
Слайд 21

Слайд 22

Слайд 23

Химические свойства железа
Взаимодействие с простыми веществами - неметаллами. 2) С серой и хлором. Запишите уравнение реакции и составьте электронный баланс.
Взаимодействие с простыми веществами - неметаллами. 2) С серой и хлором. Запишите уравнение реакции и составьте электронный баланс.
Слайд 24

0 0 +2 -2
Fe + S —>FeS
электронный баланс
Fe0 – 2e- —> Fe2+
S0 + 2e- —> S2-
+3 -1 2Fe0 + 3Cl20 —> 2FeCl3 электронный баланс Fe0 – 3e- —> Fe3+ Cl20 +2e- —> 2Cl1-
Почему железо является восстановителем?
1
2
+3 -1 2Fe0 + 3Cl20 —> 2FeCl3 электронный баланс Fe0 – 3e- —> Fe3+ Cl20 +2e- —> 2Cl1-
Почему железо является восстановителем?
1
2
Слайд 25

Химические свойства железа
Взаимодействие со сложными веществами 1) С водой. +2, +3 3Fe0 + 4H2O —> Fe3O4 + 4H20 при t =7000 - 9000
Взаимодействие со сложными веществами 1) С водой. +2, +3 3Fe0 + 4H2O —> Fe3O4 + 4H20 при t =7000 - 9000
Слайд 26

Химические свойства железа
2) С кислотами. ОПЫТ: осуществите реакцию между порошком железа и соляной кислотой.
В каком случае возможны реакции между металлом и кислотой? Составить уравнение реакции. Сделать вывод.
Fe
FeCl
2
2) С кислотами. ОПЫТ: осуществите реакцию между порошком железа и соляной кислотой.
В каком случае возможны реакции между металлом и кислотой? Составить уравнение реакции. Сделать вывод.
Fe
FeCl
2
Слайд 27

Fe + 2HCl —>FeCl2 + H2
Металлы взаимодействуют с кислотами если:
1. Металл находится в ряду активности металлов до водорода. 2. Должна получиться растворимая соль. 3. Реакция характерна для растворов кислот. 4. Металл + кислота → соль + водород
Металлы взаимодействуют с кислотами если:
1. Металл находится в ряду активности металлов до водорода. 2. Должна получиться растворимая соль. 3. Реакция характерна для растворов кислот. 4. Металл + кислота → соль + водород
Слайд 28

В концентрированных кислотах – окислителях железо растворяется только при нагревании
Слайд 29

2Fe + 6H2SO4(конц.) t˚C→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) t˚C→ Fe(NO3)3 + 3NO2 + 3H2O
Слайд 30

Химические свойства железа
3) С солями. ОПЫТ: осуществите реакцию между порошком железа и раствором хлорида меди (II).
В каком случае возможны реакции между металлом и растворами солей? Составить уравнение реакции. Сделать вывод.
3) С солями. ОПЫТ: осуществите реакцию между порошком железа и раствором хлорида меди (II).
В каком случае возможны реакции между металлом и растворами солей? Составить уравнение реакции. Сделать вывод.
Слайд 31

Fe + CuCl2 —> FeCl2 + Cu
Металлы взаимодействуют с растворами солей если:
1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. 2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми.
Металлы взаимодействуют с растворами солей если:
1. Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. 2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми.
Слайд 32

Генетические ряды железа (II) и железа (III).
Задание: запишите формулы оксида железа (II) и оксида железа (III); составьте соответствующие им формулы гидроксидов; отметьте характер этих соединений.
Задание: запишите формулы оксида железа (II) и оксида железа (III); составьте соответствующие им формулы гидроксидов; отметьте характер этих соединений.
Слайд 33

Степень окисления металла в оксиде должна соответствовать степени окисления металла в соответствующем гидроксиде
+2 +2 FeO —>Fe(OH)2 Данный оксид носит основный характер. Какие реакции подтверждают основный характер оксидов?
+3 +3 Fe2O3 —> Fe(OH)3 Какие соединения называются амфотерными?
+2 +2 FeO —>Fe(OH)2 Данный оксид носит основный характер. Какие реакции подтверждают основный характер оксидов?
+3 +3 Fe2O3 —> Fe(OH)3 Какие соединения называются амфотерными?
Слайд 34

Какие из реакций соответствуют схеме Fe+2 =>Fe+3 ?
1) 2FeCI2 + CI2 = 2FeCI3 2) FeCI3 + 3NaOH = Fe(OH)3 + 3NaCI 3) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
1) 2FeCI2 + CI2 = 2FeCI3 2) FeCI3 + 3NaOH = Fe(OH)3 + 3NaCI 3) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Слайд 35

I. Гидроксид железа (II)
Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха: FeCl2 + 2KOH = 2KCl + Fе(OH)2↓ Fe(OH)2 - слабое основание, растворимо в сильных кислотах: Fe(OH)2 + H2SO4 = FeSO4 + 2H2O Fe(OH)2 + 2H+ = Fe2+ + 2H2O
Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха: FeCl2 + 2KOH = 2KCl + Fе(OH)2↓ Fe(OH)2 - слабое основание, растворимо в сильных кислотах: Fe(OH)2 + H2SO4 = FeSO4 + 2H2O Fe(OH)2 + 2H+ = Fe2+ + 2H2O
Слайд 36

Слайд 37

Гидроксид железа (III)
Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка Fe(NO3)3 + 3KOH = Fe(OH)3↓ + 3KNO3 Fe3+ + 3OH- = Fe(OH)3↓
Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка Fe(NO3)3 + 3KOH = Fe(OH)3↓ + 3KNO3 Fe3+ + 3OH- = Fe(OH)3↓
Слайд 38

Слайд 39

Качественные реакции на ионы железа Fe2+ и Fe3+
Слайд 40

Слайд 41

Качественные реакции на ионы железа Fe2+ и Fe3+
На ионы Fe2+ +2 +3 +2 FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL красная кровяная соль синий осадок ----------------------------------------------------------------------------------------------------------- На ионы Fe3+ +3 +3 +2 FeCl3 + K4[Fe(CN)6] —> KFe[Fe(CN)6]+3KCL желтая кровяная соль синий осадок +3 +3 FeCl3 + KCNS —> Fe(CNS)3 + 3KCl роданид калия раствор красного цвета
На ионы Fe2+ +2 +3 +2 FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL красная кровяная соль синий осадок ----------------------------------------------------------------------------------------------------------- На ионы Fe3+ +3 +3 +2 FeCl3 + K4[Fe(CN)6] —> KFe[Fe(CN)6]+3KCL желтая кровяная соль синий осадок +3 +3 FeCl3 + KCNS —> Fe(CNS)3 + 3KCl роданид калия раствор красного цвета
Слайд 42

Применение железа.
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Слайд 43

Лабораторный опыт Осуществите практически цепочки химических превращений. Составьте уравнения реакций.
Вариант 1: Fe —> FeCl2 —> Fe(OH)2 —> FeO Вариант 2: Fe —> FeCl3 —> Fe(OH)3 —> Fe2O3
Вариант 1: Fe —> FeCl2 —> Fe(OH)2 —> FeO Вариант 2: Fe —> FeCl3 —> Fe(OH)3 —> Fe2O3
Слайд 44

Домашнее задание
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







