Презентация - Азот, его строение и свойства
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 95%
- Слайдов: 27
- Просмотров: 6253
- Скачиваний: 2213
- Размер: 3.11 MB
- Класс: 9
- Формат: ppt / pptx
Примеры похожих презентаций
 Почему снег белый. Его свойства и особенности
Почему снег белый. Его свойства и особенности Головной мозг, его строение и функции
Головной мозг, его строение и функции Лимон: его свойства и загадки (9 класс)
Лимон: его свойства и загадки (9 класс) Опорно-двигательная система - Строение, состав и свойства костей
Опорно-двигательная система - Строение, состав и свойства костей Строение и свойства биогеоценоза
Строение и свойства биогеоценоза Тема урока «Форма, строение, состав и свойства костей, рост костей. Типы соединения костей»
Тема урока «Форма, строение, состав и свойства костей, рост костей. Типы соединения костей» Ромб и его свойства
Ромб и его свойства
Слайды и текст этой онлайн презентации
Слайд 1

Открытый урок по химии в 9 классе
Учитель химии Кузина И.В. 2014 г.
Филиал МБОУ Токаревской СОШ №2 в с. Гладышево
Учитель химии Кузина И.В. 2014 г.
Филиал МБОУ Токаревской СОШ №2 в с. Гладышево
Слайд 2

V группа, главная подгруппа
N-азот неметалл P- фосфор неметалл As- мышьяк неметалл Sb- сурьма амфотерный металл Bi- висмут амфотерный металл
N-азот неметалл P- фосфор неметалл As- мышьяк неметалл Sb- сурьма амфотерный металл Bi- висмут амфотерный металл
Слайд 3

В воздухе он главный газ
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент…
N
N
Слайд 4

Тема урока
«Азот, его строение и свойства»
N2
«Азот, его строение и свойства»
N2
Слайд 5

Цели урока:
Сформировать представление о строении атома и молекулы азота; Изучить физические и химические свойства вещества; Развивать исторические познания в области открытия химического элемента; Раскрыть роль азота в жизни человека и растений, а также в промышленности; Повышать заинтересованность учеников и активизировать имеющиеся у них знания.
Сформировать представление о строении атома и молекулы азота; Изучить физические и химические свойства вещества; Развивать исторические познания в области открытия химического элемента; Раскрыть роль азота в жизни человека и растений, а также в промышленности; Повышать заинтересованность учеников и активизировать имеющиеся у них знания.
Слайд 6

Девиз урока:
«Нет жизни без азота, ибо он является непременной составной частью белков.» Д.Н.Прянишников
Элемент жизни
«Нет жизни без азота, ибо он является непременной составной частью белков.» Д.Н.Прянишников
Элемент жизни
Слайд 7

ПЛАН ПОРТРЕТА АЗОТА
История открытия азота. Азот в природе. Физические свойства. Строение атома и молекулы азота. Паспорт химического элемента (положение в ПСХЭ). Химические свойства. Получение азота. Области применения азота.
История открытия азота. Азот в природе. Физические свойства. Строение атома и молекулы азота. Паспорт химического элемента (положение в ПСХЭ). Химические свойства. Получение азота. Области применения азота.
Слайд 8

История открытия азота
В 1772 году английский ученый Д. Резерфорд и шведский исследователь К. Шееле обнаружили газ, который не поддерживал горение, дыхание. В 1787 году А. Лавуазье установил наличие в воздухе газа. Назвал газ «азот» - безжизненный. В 1790 году Ж. Шаптал назвал газ нитрогениум – «рождающий селитру».
Шведский ученый К. Шееле
Английский ученый Д. Резерфорд
А. Лувуазье
Ж. Шаптал
В 1772 году английский ученый Д. Резерфорд и шведский исследователь К. Шееле обнаружили газ, который не поддерживал горение, дыхание. В 1787 году А. Лавуазье установил наличие в воздухе газа. Назвал газ «азот» - безжизненный. В 1790 году Ж. Шаптал назвал газ нитрогениум – «рождающий селитру».
Шведский ученый К. Шееле
Английский ученый Д. Резерфорд
А. Лувуазье
Ж. Шаптал
Слайд 9
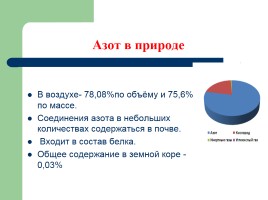
В воздухе- 78,08%по объёму и 75,6% по массе.
Соединения азота в небольших количествах содержаться в почве.
Входит в состав белка.
Общее содержание в земной коре - 0,03%
Азот в природе
Азот в природе
Слайд 10

Физические свойства
Физические свойства
Бесцветный газ, без цвета, запаха и вкуса.
Плохо растворим в воде
Ткип. -196 °C (жидкий азот)
Т пл. - 210 °C (твердый азот)
Не поддерживает горение и дыхание
Физические свойства
Бесцветный газ, без цвета, запаха и вкуса.
Плохо растворим в воде
Ткип. -196 °C (жидкий азот)
Т пл. - 210 °C (твердый азот)
Не поддерживает горение и дыхание
Слайд 11
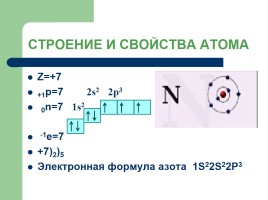
СТРОЕНИЕ И СВОЙСТВА АТОМА
Z=+7 +1p=7 2s2 2p3 0n=7 1s2 -1е=7 +7)2)5 Электронная формула азота 1S22S22P3
Z=+7 +1p=7 2s2 2p3 0n=7 1s2 -1е=7 +7)2)5 Электронная формула азота 1S22S22P3
Слайд 12
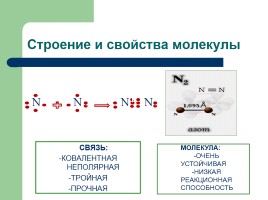
Строение и свойства молекулы
СВЯЗЬ: -КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -ТРОЙНАЯ -ПРОЧНАЯ
МОЛЕКУЛА: -ОЧЕНЬ УСТОЙЧИВАЯ -НИЗКАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ
N
N N N N
СВЯЗЬ: -КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -ТРОЙНАЯ -ПРОЧНАЯ
МОЛЕКУЛА: -ОЧЕНЬ УСТОЙЧИВАЯ -НИЗКАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ
N
N N N N
Слайд 13

Паспорт химического элемента
химический знак N Порядковый номер 7 неметалл V группа, главная подгруппа (А подгруппа) 2 период, малый период, 2 ряд Аr=14 степени окисления -3,0,+1,+2,+3,+4,+5 формула высшего оксида N2O5 летучее водородное соединение – NН3 (газ аммиак)
химический знак N Порядковый номер 7 неметалл V группа, главная подгруппа (А подгруппа) 2 период, малый период, 2 ряд Аr=14 степени окисления -3,0,+1,+2,+3,+4,+5 формула высшего оксида N2O5 летучее водородное соединение – NН3 (газ аммиак)
Слайд 14
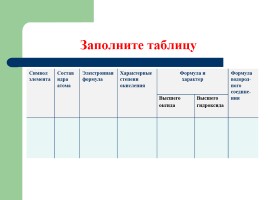
Заполните таблицу
Символ элемента Состав ядра атома Электронная формула Характерные степени окисления Формула и характер Формула и характер Формула водород- ного соедине- ния
Символ элемента Состав ядра атома Электронная формула Характерные степени окисления Высшего оксида Высшего гидроксида Формула водород- ного соедине- ния
Символ элемента Состав ядра атома Электронная формула Характерные степени окисления Формула и характер Формула и характер Формула водород- ного соедине- ния
Символ элемента Состав ядра атома Электронная формула Характерные степени окисления Высшего оксида Высшего гидроксида Формула водород- ного соедине- ния
Слайд 15

Химические свойства
Свойства окислителя А) Взаимодействие с металлами. 6Li+N2 = 2Li3N (нитрид лития) - обычные условия t 3Ca+N2= Ca3N2 (нитрид кальция) – при нагревании При взаимодействии с металлами азот проявляет степень окисления -3. Б) Взаимодействие с водородом С водородом азот взаимодействует с заметной скоростью при нагревании, повышении давлении, в присутствии катализатора: Рt N2+3H2 2NH3 + Q
Свойства окислителя А) Взаимодействие с металлами. 6Li+N2 = 2Li3N (нитрид лития) - обычные условия t 3Ca+N2= Ca3N2 (нитрид кальция) – при нагревании При взаимодействии с металлами азот проявляет степень окисления -3. Б) Взаимодействие с водородом С водородом азот взаимодействует с заметной скоростью при нагревании, повышении давлении, в присутствии катализатора: Рt N2+3H2 2NH3 + Q
Слайд 16

Химические свойства
Свойства восстановителя В) Взаимодействие с кислородом. Успешно такие реакции идут только при весьма жестких условиях. Для окисления азота кислородом нужна электрическая дуга, причем не более 5% азота вступает в реакцию. В природе такой процесс происходит повсеместно - взаимодействие азота с кислородом воздуха при грозовых разрядах подобно реакции в электрической дуге. t=20000C N2+O2 2NO – Q
Свойства восстановителя В) Взаимодействие с кислородом. Успешно такие реакции идут только при весьма жестких условиях. Для окисления азота кислородом нужна электрическая дуга, причем не более 5% азота вступает в реакцию. В природе такой процесс происходит повсеместно - взаимодействие азота с кислородом воздуха при грозовых разрядах подобно реакции в электрической дуге. t=20000C N2+O2 2NO – Q
Слайд 17

Вывод
При взаимодействии с металлами и водородом азот является окислителем. При взаимодействии с кислородом азот является восстановителем.
При взаимодействии с металлами и водородом азот является окислителем. При взаимодействии с кислородом азот является восстановителем.
Слайд 18

Проверь себя
N2+3H2 NH3 +Q Обратимая Соединения Экзотермическая ОВР Каталитическая Гомогенная
N2+O2 2NO –Q Обратимая Соединения Эндотермическая ОВР Некаталитическая Гомогенная
N2+3H2 NH3 +Q Обратимая Соединения Экзотермическая ОВР Каталитическая Гомогенная
N2+O2 2NO –Q Обратимая Соединения Эндотермическая ОВР Некаталитическая Гомогенная
Слайд 19

Получение азота
А) Промышленный способ (перегонка жидкого воздуха): воздух охлаждают и переводят в жидкое состояние, затем испарением отгоняют азот ( tкип(N2)= -1960C tкип(О2)= -1830С) Б) Лабораторный способ (разложение нитритов) NH4NO2= N2+2H2O (реакция идет при нагревании)
А) Промышленный способ (перегонка жидкого воздуха): воздух охлаждают и переводят в жидкое состояние, затем испарением отгоняют азот ( tкип(N2)= -1960C tкип(О2)= -1830С) Б) Лабораторный способ (разложение нитритов) NH4NO2= N2+2H2O (реакция идет при нагревании)
Слайд 20

Области применения азота
Свободный азот применяют во многих отраслях промышленности; в медицине (нашатырный спирт) жидкий азот применяют в холодильных установках; большое количество азота идет на синтез аммиака, из которого получают азотную кислоту, минеральные удобрения (мочевину, сульфаты и фосфаты аммония).
Свободный азот применяют во многих отраслях промышленности; в медицине (нашатырный спирт) жидкий азот применяют в холодильных установках; большое количество азота идет на синтез аммиака, из которого получают азотную кислоту, минеральные удобрения (мочевину, сульфаты и фосфаты аммония).
Слайд 21

Применение азота
Слайд 22

Азот – жизненно важный элемент
Все основные части клеток тканей организма построены из белковых молекул, в состав которых входит азот. Без белка нет жизни, а без азота нет белка. Азот в виде аммиака и соединений аммония окисляется до нитратов и нитритов (хорошо растворимых в воде). Затем попадают в Мировой океан, разлагаются и азот выделяется в атмосферу.
“С биологической точки зрения азот более драгоценен, чем любой из драгоценных металлов” В.Л. Омелянский
Все основные части клеток тканей организма построены из белковых молекул, в состав которых входит азот. Без белка нет жизни, а без азота нет белка. Азот в виде аммиака и соединений аммония окисляется до нитратов и нитритов (хорошо растворимых в воде). Затем попадают в Мировой океан, разлагаются и азот выделяется в атмосферу.
“С биологической точки зрения азот более драгоценен, чем любой из драгоценных металлов” В.Л. Омелянский
Слайд 23

Вопросы для самоконтроля
Газ без цвета , вкуса и запаха Молекула двухатомна Содержание в воздухе 78 % В лаборатории получают разложением KMnO4 и H2O2 В промышленности – из жидкого воздуха Химически малоактивен Взаимодействует почти со всеми простыми веществами С ним связаны процессы дыхания и фотосинтеза Является составной частью белков Участвует в круговороте веществ в природе
Газ без цвета , вкуса и запаха Молекула двухатомна Содержание в воздухе 78 % В лаборатории получают разложением KMnO4 и H2O2 В промышленности – из жидкого воздуха Химически малоактивен Взаимодействует почти со всеми простыми веществами С ним связаны процессы дыхания и фотосинтеза Является составной частью белков Участвует в круговороте веществ в природе
Слайд 24

Проверь себя
N2 1, 2, 3, 5, 6, 9, 10. « 5 » 1-2 ошибки « 4 » 3-4 ошибки « 3 » 5 ошибок и более « 2 »
N2 1, 2, 3, 5, 6, 9, 10. « 5 » 1-2 ошибки « 4 » 3-4 ошибки « 3 » 5 ошибок и более « 2 »
Слайд 25

Рефлексия
• Сегодня на уроке я узнал (а)... • Сегодня на уроке я научилась (ся)... • Я доволен(на) своей работой на уроке?
• Сегодня на уроке я узнал (а)... • Сегодня на уроке я научилась (ся)... • Я доволен(на) своей работой на уроке?
Слайд 26

Домашнее задание
Параграф №24 , выполнить задания 3,4 на странице 146 Составить рассказ на тему: «Путешествие азота в природе»
Параграф №24 , выполнить задания 3,4 на странице 146 Составить рассказ на тему: «Путешествие азота в природе»
Слайд 27

Урок закончен!
МОЛОДЦЫ !
МОЛОДЦЫ !
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
