Презентация - Вода
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 84%
- Слайдов: 21
- Просмотров: 5251
- Скачиваний: 2378
- Размер: 1.72 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Вода
Слайд 2

Вода
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи
Слайд 3

Вода в природе
Большая часть поверхности Земли покрыта морями и океанами -
71%
Морская вода – 97% - 98%
Пресная вода – 2% - 3%
75% - ее сковано льдом, находится под землей
Таким образом человек может пользоваться только 0,02% – 0,03% всей воды на нашей планете.
Большая часть поверхности Земли покрыта морями и океанами -
71%
Морская вода – 97% - 98%
Пресная вода – 2% - 3%
75% - ее сковано льдом, находится под землей
Таким образом человек может пользоваться только 0,02% – 0,03% всей воды на нашей планете.
Слайд 4

Состав воды
Метод определения состава вещества путем его разложения на более простые наз. АНАЛИЗОМ Получение сложных веществ из более простых наз. СИНТЕЗОМ Для определения состава веществ и вывода их хим. Формул используют как анализ, так и синтез.
Метод определения состава вещества путем его разложения на более простые наз. АНАЛИЗОМ Получение сложных веществ из более простых наз. СИНТЕЗОМ Для определения состава веществ и вывода их хим. Формул используют как анализ, так и синтез.
Слайд 5

Очистка воды
Сначала воду отстаивают в специальных бассейнах и фильтруют через слой песка. Затем обрабатывают хлором, иногда озоном или ультрафиолетовыми лучами, которые убивают микроорганизмы.
Сначала воду отстаивают в специальных бассейнах и фильтруют через слой песка. Затем обрабатывают хлором, иногда озоном или ультрафиолетовыми лучами, которые убивают микроорганизмы.
Слайд 6

Чтобы очистить воду от растворенных в ней веществ, применяют перегонку, или дистилляцию.
Для очистки воды используют аэрацию – насыщение ее кислородом.
Слайд 7

Физические свойства воды
Вода – единственное вещество в природе, которое в земных условиях существует во всех трех агрегатных состояниях: жидком (вода), твердом (лед), газообразном (пар).
Пар
Жидкость
Лед
Вода – единственное вещество в природе, которое в земных условиях существует во всех трех агрегатных состояниях: жидком (вода), твердом (лед), газообразном (пар).
Пар
Жидкость
Лед
Слайд 8

Вода в организме человека
Кровь человека на 90% состоит из воды Мышцы на 75% Кости на 28% Стекловидное тело глаза на 99%
Кровь человека на 90% состоит из воды Мышцы на 75% Кости на 28% Стекловидное тело глаза на 99%
Слайд 9

Вода в организме человека
Обезвоживание организма на 12 – 15 % приводит к нарушению обмена веществ, А потеря до 25 % воды – к гибели организма
Без воды человек может прожить 3 дня, в то время, как без пищи 30 – 50 дней
Обезвоживание организма на 12 – 15 % приводит к нарушению обмена веществ, А потеря до 25 % воды – к гибели организма
Без воды человек может прожить 3 дня, в то время, как без пищи 30 – 50 дней
Слайд 10

Аномалии воды
Лёд плавает на поверхности водоёма, (льда) = 0,92 г/см3, max (воды) при +4°С = 1г/см3
При замерзании воды происходит расширение объёма.
Самая большая теплоемкость ( в 3100 раз больше, чем у воздуха, в 4 раза больше, чем у горных пород)
Молекулы взаимодействуют между собой с образованием водородных связей.
Лёд плавает на поверхности водоёма, (льда) = 0,92 г/см3, max (воды) при +4°С = 1г/см3
При замерзании воды происходит расширение объёма.
Самая большая теплоемкость ( в 3100 раз больше, чем у воздуха, в 4 раза больше, чем у горных пород)
Молекулы взаимодействуют между собой с образованием водородных связей.
Слайд 11
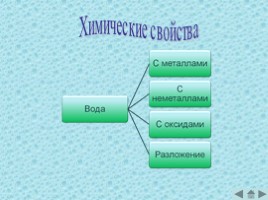
Химические свойства
Слайд 12

Взаимодействие с металлами
При взаимодействии воды с активными металлами образуется щелочь и водород:
2Na + 2H2О= H2 + 2NaOH (бурно) 2K + 2H2О = H2 + 2KOH (бурно)
При взаимодействии воды с менее активными металлами ( при нагревании) образуется оксид и водород:
3Fe + 4H2О = 4H2 + Fe3О4 (только при нагревании)
При взаимодействии воды с активными металлами образуется щелочь и водород:
2Na + 2H2О= H2 + 2NaOH (бурно) 2K + 2H2О = H2 + 2KOH (бурно)
При взаимодействии воды с менее активными металлами ( при нагревании) образуется оксид и водород:
3Fe + 4H2О = 4H2 + Fe3О4 (только при нагревании)
Слайд 13

Взаимодействие с неметаллами
Вода взаимодействует с некоторыми неметаллами; получающиеся продукты взаимодействия очень разнообразны:
C + H2О = H2 + CO (при сильном нагревании)
Cl2 + H2О = HClO + HCl
Реакция разложения воды
Под действием постоянного электрического тока или высокой температуры вода разлагается на кислород и водород:
2Н2О = 2Н2 + О2
Вода взаимодействует с некоторыми неметаллами; получающиеся продукты взаимодействия очень разнообразны:
C + H2О = H2 + CO (при сильном нагревании)
Cl2 + H2О = HClO + HCl
Реакция разложения воды
Под действием постоянного электрического тока или высокой температуры вода разлагается на кислород и водород:
2Н2О = 2Н2 + О2
Слайд 14

Взаимодействие с основными оксидами
Взаимодействие с кислотными оксидами
Некоторые оксиды металлов могут вступать в реакции соединения с водой, в результате этой реакции образуется щелочь:
SO3 + H2O = H2SO4
CO2 + H2O = H2CO3
СаО + Н2О = Са(ОН)2
Na2O + H2O =2 NaOH
Некоторые кислотные оксиды вступают в реакции соединения с водой, в результате образуются кислоты:
Взаимодействие с кислотными оксидами
Некоторые оксиды металлов могут вступать в реакции соединения с водой, в результате этой реакции образуется щелочь:
SO3 + H2O = H2SO4
CO2 + H2O = H2CO3
СаО + Н2О = Са(ОН)2
Na2O + H2O =2 NaOH
Некоторые кислотные оксиды вступают в реакции соединения с водой, в результате образуются кислоты:
Слайд 15

Круговорот воды в природе
Вода постоянно испаряется с поверхности наземных водоемов, листьев растений Так возникает водяной пар, который, конденсируясь, ставновится облаками.
Атмосферная вода попадает на землю в виде осадков.
Но не нужно думать, что круговорот – это панацея от исчерпания доступных запасов пресной воды. Все же он происходит медленно.
Берегите воду!
Вода постоянно испаряется с поверхности наземных водоемов, листьев растений Так возникает водяной пар, который, конденсируясь, ставновится облаками.
Атмосферная вода попадает на землю в виде осадков.
Но не нужно думать, что круговорот – это панацея от исчерпания доступных запасов пресной воды. Все же он происходит медленно.
Берегите воду!
Слайд 16
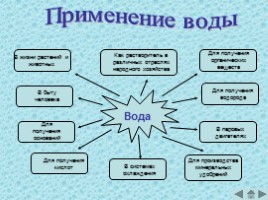
Применение воды
Вода
В жизни растений и животных
В быту человека
Для получения оснований
Для получения кислот
Как растворитель в различных отраслях народного хозяйства
В системах охлаждения
Для получения органических веществ
Для получения водорода
В паровых двигателях
Для производства минеральных удобрений
Применение воды
Вода
В жизни растений и животных
В быту человека
Для получения оснований
Для получения кислот
Как растворитель в различных отраслях народного хозяйства
В системах охлаждения
Для получения органических веществ
Для получения водорода
В паровых двигателях
Для производства минеральных удобрений
Применение воды
Слайд 17

Вода необходима всем живым организмам: растениям, животным и человеку. Без воды нет жизни. Вода – одно из самых главных богатств Земли.
Слайд 18

Берегите воду
Слайд 19

« Вода – у тебя нет ни цвета, ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое.
Нельзя сказать, что ты необходима для жизни: ты – сама жизнь!»
Антуан Сент – Экзюпери
Слайд 20
Тест по теме «Вода»
Вопрос 1
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
Вопрос 6
Вопрос 7
Вопрос 8
Вопрос 9
Вопрос 10
+
-
+
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
-
-
Вопрос 1
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
Вопрос 6
Вопрос 7
Вопрос 8
Вопрос 9
Вопрос 10
+
-
+
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
-
-
Слайд 21

^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







