Презентация - Магний (Mg)
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 90%
- Слайдов: 17
- Просмотров: 5417
- Скачиваний: 1546
- Размер: 2.04 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1
Магний(Mg)
Слайд 2

План
1. История открытия магния 2. Магний 3. Распространение Магния в природе 4. Физические свойства Магния 5. Химические свойства Магния 6. Применение магния 7. Биологическая роль 8. Интересные факты
1. История открытия магния 2. Магний 3. Распространение Магния в природе 4. Физические свойства Магния 5. Химические свойства Магния 6. Применение магния 7. Биологическая роль 8. Интересные факты
Слайд 3

История открытия магния
Соединения магния были известны человеку очень давно. Магнезитом (по-гречески Magnhsia oliqV) называли мягкий белый, мылкий на ощупь минерал (мыльный камень, или тальк), который находили в районе Магнезии в Фессалии. При прокаливании этого минерала получали белый порошок, который стали именовать белой магнезией. В 1695 Н.Гро, выпаривая минеральную воду Эпсомского источника (Англия), получил соль, обладавшую горьким вкусом и слабительным действием (MgSO4·7H2O). Спустя несколько лет выяснилось, что при взаимодействии с содой или поташом эта соль образует белый рыхлый порошок, такой же, какой образуется при прокаливании магнезита.
Камень Магнезит
Соединения магния были известны человеку очень давно. Магнезитом (по-гречески Magnhsia oliqV) называли мягкий белый, мылкий на ощупь минерал (мыльный камень, или тальк), который находили в районе Магнезии в Фессалии. При прокаливании этого минерала получали белый порошок, который стали именовать белой магнезией. В 1695 Н.Гро, выпаривая минеральную воду Эпсомского источника (Англия), получил соль, обладавшую горьким вкусом и слабительным действием (MgSO4·7H2O). Спустя несколько лет выяснилось, что при взаимодействии с содой или поташом эта соль образует белый рыхлый порошок, такой же, какой образуется при прокаливании магнезита.
Камень Магнезит
Слайд 4

Магний
Магний (лат. Magnesium), Mg, химический элемент II группы периодической системы Менделеева, атомный номер 12, атомная масса 24,305. Природный Магний состоит из трех стабильных изотопов: 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%). Магний открыт в 1808 году Г. Дэви, который подверг электролизу с ртутным катодом увлажненную магнезию (давно известное вещество); Дэви получил амальгаму, а из нее после отгонки ртути - новый порошкообразный металл, названный магнием. В 1828 году французский химик А. Бюсси восстановлением расплавленного хлорида Магния парами калия получил Магний в виде небольших шариков с металлическим блеском.
Магний (лат. Magnesium), Mg, химический элемент II группы периодической системы Менделеева, атомный номер 12, атомная масса 24,305. Природный Магний состоит из трех стабильных изотопов: 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%). Магний открыт в 1808 году Г. Дэви, который подверг электролизу с ртутным катодом увлажненную магнезию (давно известное вещество); Дэви получил амальгаму, а из нее после отгонки ртути - новый порошкообразный металл, названный магнием. В 1828 году французский химик А. Бюсси восстановлением расплавленного хлорида Магния парами калия получил Магний в виде небольших шариков с металлическим блеском.
Слайд 5
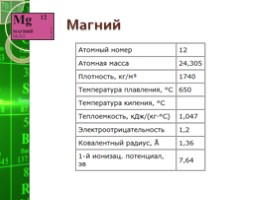
Магний
Слайд 6

Распространение Магния в природе
Магний - характерный элемент мантии Земли, в ультраосновных породах его содержится 25,9% по массе. В земной коре Магния меньше, средний кларк его 1,87%; преобладает Магний в основных породах (4,5%), в гранитах и других кислых породах его меньше (0,56%). В магматических процессах Mg2+ - аналог Fe2+, что объясняется близостью их ионных радиусов (соответственно 0,74 и 0,80 Å). Mg2+ вместе с Fe2+ входит в состав оливина, пироксенов и других магматических минералов.
Магний - характерный элемент мантии Земли, в ультраосновных породах его содержится 25,9% по массе. В земной коре Магния меньше, средний кларк его 1,87%; преобладает Магний в основных породах (4,5%), в гранитах и других кислых породах его меньше (0,56%). В магматических процессах Mg2+ - аналог Fe2+, что объясняется близостью их ионных радиусов (соответственно 0,74 и 0,80 Å). Mg2+ вместе с Fe2+ входит в состав оливина, пироксенов и других магматических минералов.
Слайд 7

Минералы Магния многочисленны - силикаты, карбонаты, сульфаты, хлориды и другие. Более половины из них образовались в биосфере - на дне морей, озер, в почвах и т. д.; остальные связаны с высокотемпературными процессами.
В биосфере наблюдается энергичная миграция и дифференциация Магния; здесь главная роль принадлежит физико-химическим процессам - растворению, осаждению солей, сорбции Магний глинами. Магний слабо задерживается в биологическом круговороте на континентах и с речным стоком поступает в океан. В морской воде в среднем 0,13% Магния - меньше, чем натрия, но больше всех других металлов. Морская вода не насыщена Магнием и осаждения его солей не происходит. При испарении воды в морских лагунах в осадках вместе с солями калия накапливаются сульфаты и хлориды Магния. В илах некоторых озер накапливается доломит (например, в озере Балхаш). В промышленности Магний получают в основном из доломитов, а также из морской воды.
Слайд 8

Распространение Магния в природе
Главными видами нахождения магнезиального сырья являются: морская вода — (Mg 0,12-0,13 %), карналлит — MgCl2 • KCl • 6H2O (Mg 8,7 %), бишофит — MgCl2 • 6H2O (Mg 11,9 %), кизерит — MgSO4 • H2O (Mg 17,6 %), эпсомит — MgSO4 • 7H2O (Mg 16,3 %), каинит — KCl • MgSO4 • 3H2O (Mg 9,8 %), магнезит — MgCO3 (Mg 28,7 %), доломит — CaCO3·MgCO3 (Mg 13,1 %), брусит — Mg(OH)2 (Mg 41,6 %). Типы месторождений Ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные соли) Морская вода Рассолы (рапа соляных озёр) Природные карбонаты (доломит и магнезит) Главные месторождения находятся на территории США, Норвегии, Китая, России
Главными видами нахождения магнезиального сырья являются: морская вода — (Mg 0,12-0,13 %), карналлит — MgCl2 • KCl • 6H2O (Mg 8,7 %), бишофит — MgCl2 • 6H2O (Mg 11,9 %), кизерит — MgSO4 • H2O (Mg 17,6 %), эпсомит — MgSO4 • 7H2O (Mg 16,3 %), каинит — KCl • MgSO4 • 3H2O (Mg 9,8 %), магнезит — MgCO3 (Mg 28,7 %), доломит — CaCO3·MgCO3 (Mg 13,1 %), брусит — Mg(OH)2 (Mg 41,6 %). Типы месторождений Ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные соли) Морская вода Рассолы (рапа соляных озёр) Природные карбонаты (доломит и магнезит) Главные месторождения находятся на территории США, Норвегии, Китая, России
Слайд 9

Распространение Магния в природе
Брусит
Доломит
Магнезит
Каинит
Карналлит
Брусит
Доломит
Магнезит
Каинит
Карналлит
Слайд 10

Физические свойства Магния
Магний - серебристо-белый металл с плотностью 1,74 г/см3, плавится при 651 град. С, кипит при 1110 град. С. На холоде магний покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления кислородом воздуха.
Магний - серебристо-белый металл с плотностью 1,74 г/см3, плавится при 651 град. С, кипит при 1110 град. С. На холоде магний покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления кислородом воздуха.
Слайд 11

Химические свойства Магния
Магний - активный металл. Если разрушить оксидную пленку на его поверхности, он легко окисляется кислородом воздуха. При нагревании магний энергично взаимодействует с галогенами, серой, азотом, фосфором, углеродом, кремнием и другими элементами: 2 Мg + O2 = 2 МgО (оксид магния); Мg + Сl2 = МgСl2 (хлорид магния); 3 Mg + N2 = Мg3N2 (нитрид магния); 3 Мg + 2 Р= Мg3Р2 (фосфид магния); 2 Мg + Si = Мg2Si (силицид магния).
Магний - активный металл. Если разрушить оксидную пленку на его поверхности, он легко окисляется кислородом воздуха. При нагревании магний энергично взаимодействует с галогенами, серой, азотом, фосфором, углеродом, кремнием и другими элементами: 2 Мg + O2 = 2 МgО (оксид магния); Мg + Сl2 = МgСl2 (хлорид магния); 3 Mg + N2 = Мg3N2 (нитрид магния); 3 Мg + 2 Р= Мg3Р2 (фосфид магния); 2 Мg + Si = Мg2Si (силицид магния).
Слайд 12

Химические свойства Магния
Магний не растворяется в воде, однако, при нагревании довольно активно взаимодействует с парами воды: Мg + Н2О = МgО + Н2. Магний легко отнимает кислород и галогены у многих металлов, поэтому его используют для получения редких металлов из их соединений: 3Мg + МоО3 = 3 МgО + Мо; 2Мg + ZrСl4 = 2 МgСl2 + Zr.
Магний не растворяется в воде, однако, при нагревании довольно активно взаимодействует с парами воды: Мg + Н2О = МgО + Н2. Магний легко отнимает кислород и галогены у многих металлов, поэтому его используют для получения редких металлов из их соединений: 3Мg + МоО3 = 3 МgО + Мо; 2Мg + ZrСl4 = 2 МgСl2 + Zr.
Слайд 13

Химические свойства Магния
Магний горит в атмосфере углекислого газа: Мg + СО2 = МgО+ СО или 2 Мg + СО2 = 2 МgО + С и хорошо растворяется в кислотах: Мg + Н2SO4 = МgSО4 + Н2; 4 Мg + 10 НNО3 = 4 Мg(NО3)2 + N2O + 5 Н2О.
Магний горит в атмосфере углекислого газа: Мg + СО2 = МgО+ СО или 2 Мg + СО2 = 2 МgО + С и хорошо растворяется в кислотах: Мg + Н2SO4 = МgSО4 + Н2; 4 Мg + 10 НNО3 = 4 Мg(NО3)2 + N2O + 5 Н2О.
Слайд 14

Применение Магния
Основная часть добываемого магния используется для получения различных легких магниевых сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей. Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например: 2Mg + TiO2 = 2MgO + Ti. 2Mg + UF4 = 2MgF2 + U. Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат.
Основная часть добываемого магния используется для получения различных легких магниевых сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей. Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например: 2Mg + TiO2 = 2MgO + Ti. 2Mg + UF4 = 2MgF2 + U. Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат.
Слайд 15

Биологическая роль
Магний — биогенный элемент, постоянно присутствующий в тканях всех организмов. Он входит в состав молекулы зеленого пигмента растений — хлорофилла, участвует в минеральном обмене, активирует ферментные процессы в организме, повышает засухоустойчивость растений. С участием ионов Mg+ осуществляется биолюминесценция и ряд других биологических процессов. Широкое практическое применение находят магниевые удобрения — доломитовая мука, жженая магнезия и др.
Магний — биогенный элемент, постоянно присутствующий в тканях всех организмов. Он входит в состав молекулы зеленого пигмента растений — хлорофилла, участвует в минеральном обмене, активирует ферментные процессы в организме, повышает засухоустойчивость растений. С участием ионов Mg+ осуществляется биолюминесценция и ряд других биологических процессов. Широкое практическое применение находят магниевые удобрения — доломитовая мука, жженая магнезия и др.
Слайд 16

Биологическая роль
В организм животных и человека магний поступает с пищей. Суточная потребность человека в магнии — 0,3-0,5 г. В организме среднего человека (масса тела 70 кг) содержится около 19 г магния. Нарушения обмена магния приводят к различным заболеваниям. В медицине применяют препараты магния — его сульфат, карбонат, жженую магнезию.
В организм животных и человека магний поступает с пищей. Суточная потребность человека в магнии — 0,3-0,5 г. В организме среднего человека (масса тела 70 кг) содержится около 19 г магния. Нарушения обмена магния приводят к различным заболеваниям. В медицине применяют препараты магния — его сульфат, карбонат, жженую магнезию.
Слайд 17

Интересные факты
СЫРЬЕ НА МОСТОВОЙ. При желании магний можно добывать даже из... простого булыжника: ведь в каждом килограмме камня, исподьзуемого для мощения дорог, содержится примерно 20 грамм магния. В таком процессе, правда, пока нет необходимости — магний из дорожного камня был бы слишком дорогим удовольствием. МАГНИЙ И... ИНФАРКТ. Опыты, проведенные венгерскими учеными на животных, показали, что недостаток магния в организме повышает предрасположенность к инфарктам. Одним собакам давали пищу, богатую солями этого элемента, другим — бедную. К концу эксперимента те собаки, в рационе которых было мало магния, "заработали" инфаркт миокарда.
СЫРЬЕ НА МОСТОВОЙ. При желании магний можно добывать даже из... простого булыжника: ведь в каждом килограмме камня, исподьзуемого для мощения дорог, содержится примерно 20 грамм магния. В таком процессе, правда, пока нет необходимости — магний из дорожного камня был бы слишком дорогим удовольствием. МАГНИЙ И... ИНФАРКТ. Опыты, проведенные венгерскими учеными на животных, показали, что недостаток магния в организме повышает предрасположенность к инфарктам. Одним собакам давали пищу, богатую солями этого элемента, другим — бедную. К концу эксперимента те собаки, в рационе которых было мало магния, "заработали" инфаркт миокарда.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.







