Презентация - Гидролиз солей
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 96%
- Слайдов: 20
- Просмотров: 3909
- Скачиваний: 1260
- Размер: 1.45 MB
- Онлайн: Да
- Формат: ppt / pptx
Слайды и текст этой онлайн презентации
Слайд 1

Гидролиз солей
Слайд 2

Гидролизом соли называется взаимодействие ионов соли с водой,
в результате которого изменяется рН среды.
В процессе гидролиза соли в водном растворе появляется избыток катионов Н+ или анионов ОН-
ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
Слайд 3
Слайд 4
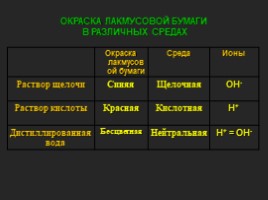
ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
Окраска лакмусовой бумаги Среда Ионы
Раствор щелочи Синяя Щелочная ОН-
Раствор кислоты Красная Кислотная Н+
Дистиллированная вода Бесцветная Нейтральная Н+ = ОН-
Окраска лакмусовой бумаги Среда Ионы
Раствор щелочи Синяя Щелочная ОН-
Раствор кислоты Красная Кислотная Н+
Дистиллированная вода Бесцветная Нейтральная Н+ = ОН-
Слайд 5

В зависимости от силы исходной кислоты и исходного основания, образовавших соль, выделяют 4 типа солей.
Соли, образованные катионом сильного основания и анионом слабой кислоты. Они подвергаются гидролизу по аниону. К таким солям относятся: Na2CO3, Na2S, K2SO3, CH3COOK, NaCN, Ba(NO2)2 и т. д. Их растворы имеют щелочную реакцию среды, рН > 7. Лакмус в таких растворах синий, фенолфталеин приобретает малиновую окраску, метилоранж - жёлтый.
Na2S ↔ 2Na+ + S2- S2- + H2O ↔ HS- + OH- Na2S + H2O ↔ NaHS + NaOH
Слайд 6

Механизм гидролиза карбоната натрия
H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3- +2Na+ +OH-
H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3- +2Na+ +OH-
Слайд 7

CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая соль.
Сформулируем вывод: Раствор соли, образованной ________________, имеет__________реакцию, так как в растворе избыток ________________.
Сформулируем вывод: Раствор соли, образованной ________________, имеет__________реакцию, так как в растворе избыток ________________.
Слайд 8
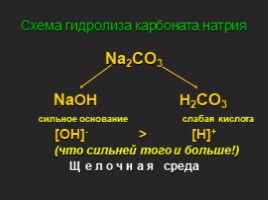
Схема гидролиза карбоната натрия
Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда
Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда
Слайд 9

FeCl2 ↔ Fe2+ + 2Cl-
Fe2+ + H2O ↔ (FeOH)+ + H+
FeCl2 + H2O ↔ FeOHCl + HCl
2. Cоли, образованные катионом слабого основания и анионом сильной кислоты. Они подвергаются гидролизу по катиону. К таким солям относятся: ZnCl2, FeCl3, CuCl2, NH4I, Al2(SO4)3 и др.. Их растворы имеют кислую реакцию среды, рН < 7. Лакмус и метилоранж в таких растворах имеют красный цвет, фенолфталеин не изменяет окраски.
2. Cоли, образованные катионом слабого основания и анионом сильной кислоты. Они подвергаются гидролизу по катиону. К таким солям относятся: ZnCl2, FeCl3, CuCl2, NH4I, Al2(SO4)3 и др.. Их растворы имеют кислую реакцию среды, рН < 7. Лакмус и метилоранж в таких растворах имеют красный цвет, фенолфталеин не изменяет окраски.
Слайд 10

Механизм гидролиза хлорида алюминия
H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al OH2+ +H+ + 3Cl-
H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al OH2+ +H+ + 3Cl-
Слайд 11

Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной обменной реакции является основная соль.
Сформулируем вывод: Раствор соли, образованной ________________, имеет _____________реакцию, так как в растворе избыток___________________.
Сформулируем вывод: Раствор соли, образованной ________________, имеет _____________реакцию, так как в растворе избыток___________________.
Слайд 12
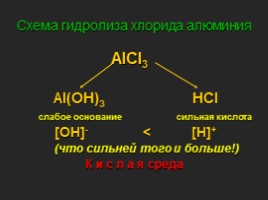
Схема гидролиза хлорида алюминия
AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л а я среда
AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л а я среда
Слайд 13

4. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу.
К таким солям относятся: NaCl, K2SO4, NaNO3.
Их растворы имеют нейтральную реакцию среды, рН = 7.
Окраска индикаторов в таких растворах не изменяется.
3. Соли, образованные катионом слабого основания и анионом слабой кислоты. Они подвергаются гидролизу по катиону и по аниону одновременно. К таким солям относятся: CH3COONH4, (NH4)2S, NH4CN. Реакция среды их растворов может быть нейтральной, слабо щелочной или слабо кислотной в зависимости константы диссоциации образующихся продуктов.
CH3COONH4 ↔ CH3COO- + NH4+ CH3COO- + NH4+ + H2O ↔ CH3COOH + NH4OH CH3COONH4 + H2O ↔ CH3COOH + NH4OH
КД (СН3СООН) = КД (NH4OН) , поэтому рН раствора =7
3. Соли, образованные катионом слабого основания и анионом слабой кислоты. Они подвергаются гидролизу по катиону и по аниону одновременно. К таким солям относятся: CH3COONH4, (NH4)2S, NH4CN. Реакция среды их растворов может быть нейтральной, слабо щелочной или слабо кислотной в зависимости константы диссоциации образующихся продуктов.
CH3COONH4 ↔ CH3COO- + NH4+ CH3COO- + NH4+ + H2O ↔ CH3COOH + NH4OH CH3COONH4 + H2O ↔ CH3COOH + NH4OH
КД (СН3СООН) = КД (NH4OН) , поэтому рН раствора =7
Слайд 14

Механизм гидролиза хлорида натрия
H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl- + Na+ + HOH Данная соль гидролизу не подвергается.
H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl- + Na+ + HOH Данная соль гидролизу не подвергается.
Слайд 15

NaCl + Н2О =
Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
Слайд 16
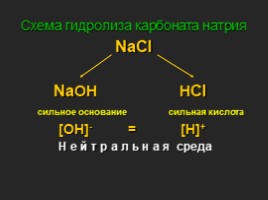
Схема гидролиза карбоната натрия
NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда
NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда
Слайд 17
Самостоятельно заполните таблицу
Название соли Уравнение гидролиза Среда раствора Окраска лакмусовой бумаги
Карбонат калия
Нитрат железа (II)
Хлорид бария
Название соли Уравнение гидролиза Среда раствора Окраска лакмусовой бумаги
Карбонат калия
Нитрат железа (II)
Хлорид бария
Слайд 18
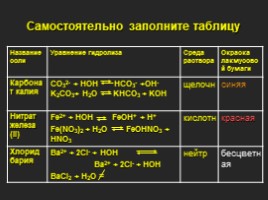
Самостоятельно заполните таблицу
Название соли Уравнение гидролиза Среда раствора Окраска лакмусовой бумаги
Карбонат калия CO32- + HOH HCO3- +OH- K2CO3+ H2O KHCO3 + KOH щелочн синяя
Нитрат железа (II) Fe2+ + HOH FeOH+ + H+ Fe(NO3)2 + H2O FeOHNO3 + HNO3 кислотн красная
Хлорид бария Ba2+ + 2Cl- + HOH Ba2+ + 2Cl- + HOH BaCl2 + H2O = нейтр бесцветная
Название соли Уравнение гидролиза Среда раствора Окраска лакмусовой бумаги
Карбонат калия CO32- + HOH HCO3- +OH- K2CO3+ H2O KHCO3 + KOH щелочн синяя
Нитрат железа (II) Fe2+ + HOH FeOH+ + H+ Fe(NO3)2 + H2O FeOHNO3 + HNO3 кислотн красная
Хлорид бария Ba2+ + 2Cl- + HOH Ba2+ + 2Cl- + HOH BaCl2 + H2O = нейтр бесцветная
Слайд 19

Количественной характеристикой гидролиза является степень гидролиза α (которую выражают в процентах).
где n - число моль формульных единиц соли подвергшихся гидролизу, N - общее число моль формульных единиц соли в растворе.
Степень гидролиза зависит от природы соли, концентрации и температуры раствора, наличия в растворе одноименных ионов.
Степень гидролиза увеличивается при разбавлении раствора и повышении температуры.
Степень гидролиза уменьшается с понижением температуры раствора, повышением концентрации раствора, введением в раствор одноименных ионов.
Так, если в раствор фторида калия (F- + H2O ↔ HF + OH-) добавить щелочь, то равновесие гидролиза сместится влево и гидролиз уменьшится.
Факторы, влияющие на степень гидролиза
Факторы, влияющие на степень гидролиза
Слайд 20

Для большинства солей гидролиз обратимый процесс.
Однако есть соли, продукты гидролиза которых выводятся из сферы реакции, и гидролиз становится необратимым.
Такими солями являются: Al2S3, (NH4)2S, Fe2(CO3)3, (NH4)2SiO3
В уравнениях необратимого гидролиза солей ставится знак равенства:
Al2S3 + 6H2O = 2Al(OH)3↓+ 3H2S↑.
Необратимому гидролизу подвергаются также бинарные соединения:
Mg3N2, CaC2, Р2S5
Необратимый гидролиз
Запишите гидролиз бинарных соединений самостоятельно
Необратимый гидролиз
Запишите гидролиз бинарных соединений самостоятельно
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.