Слайды и текст этой онлайн презентации
Слайд 1
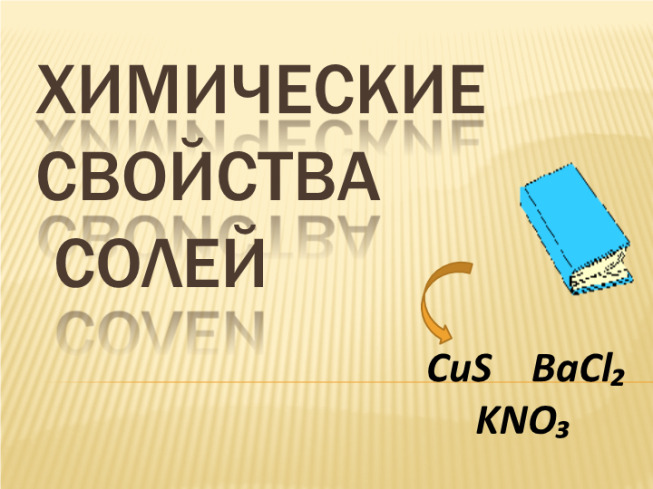
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
CuS BaCl₂
KNO₃
Слайд 2
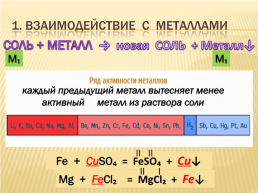
1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
СОЛЬ + МЕТАЛЛ → новая СОЛЬ + Металл↓
М₁
М₁
каждый предыдущий металл вытесняет менее активный металл из раствора соли
II
II
Fe + CuSO₄ = FeSO₄ + Cu↓
II
I
Mg + FeCl₂ = MgCl₂ + Fe↓
Слайд 3
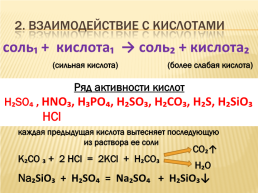
2. Взаимодействие с кислотами
соль₁ + кислота₁ → соль₂ + кислота₂
(сильная кислота) (более слабая кислота)
Ряд активности кислот
H₂SO₄ , HNO₃, H₃PO₄, H₂SO₃, H₂CO₃, H₂S, H₂SiO₃
HCl
каждая предыдущая кислота вытесняет последующую
из раствора ее соли
CO₂↑
K₂CO ₃ + 2 HCl = 2KCl + H₂CO₃
H₂O
Na₂SiO₃ + H₂SO₄ = Na₂SO₄ + H₂SiO₃↓
Слайд 4
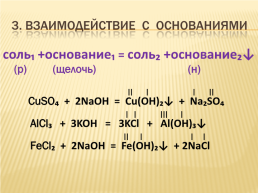
3. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ
соль₁ +основание₁ = соль₂ +основание₂↓
(р) (щелочь) (н)
II
I
I
II
CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
I
I
III
I
AlCl₃ + 3KOH = 3KCl + Al(OH)₃↓
II
I
I
I
FeCl₂ + 2NaOH = Fe(OH)₂↓ + 2NaCl
Слайд 5
4. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
соль₁ +соль₂= новая соль₁↓+ новая соль₂
II
II
I
I
BaCl₂ + Na₂SO₄ = BaSO₄↓ + 2NaCl
I
I
II
II
Cu(NO₃)₂ + K₂S = 2KNO₃ + CuS↓
Слайд 6
5. РАЗЛОЖЕНИЕ ПРИ НАГРЕВАНИИ НЕРАСТВОРИМЫХ СОЛЕЙ
t⁰C
соль ↓ → оксид металла + оксид неметалла
II
II
IV
II
BaSiO₃↓ = BaO + SiO₂
CaCO₃↓ = CaO + CO₂
V
II
Ca₃(PO₄)₂↓ = 3CaO + P₂O₅
 Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Химические свойства металлов - Электрохимический ряд напряжения металлов
Химические свойства металлов - Электрохимический ряд напряжения металлов Общие химические свойства металлов
Общие химические свойства металлов Химические свойства кислот
Химические свойства кислот Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Текстильные материалы из химических волокон - Свойства химических волокон
Текстильные материалы из химических волокон - Свойства химических волокон Физико-химические свойства аммиака
Физико-химические свойства аммиака