Слайды и текст этой онлайн презентации
Слайд 1
Электролиз расплавов и водных растворов солей
Единственный путь, ведущий к знанию, – это деятельность.
Б. Шоу
Слайд 2
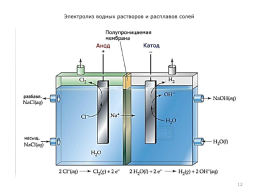
Электролиз водных растворов и расплавов солей
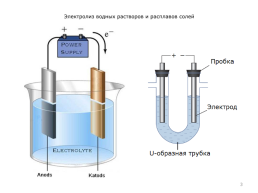
Электролиз – это окислительно-восстановительный процесс, происходящий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами – проводниками, соединенными с полюсами источника электрической энергии.
Анодом при электролизе называется положительный электрод, катодом – отрицательный.
Положительные ионы – катионы – (ионы металлов, ионы водорода, ионы аммония и др.) – движутся к катоду, отрицательные ионы – анионы – (ионы кислотных остатков и гидроксильные группы) – движутся к аноду.
Слайд 3
Электролиз водных растворов и расплавов солей
Слайд 4
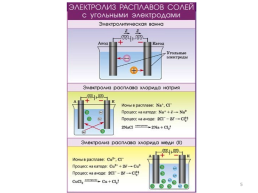
Электролиз расплавов
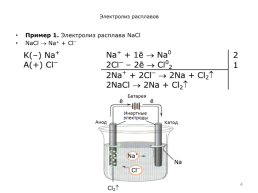
Пример 1. Электролиз расплава NaCl
NaCl Na+ + Cl⎺
Слайд 6
Электролиз расплавов
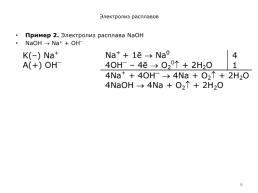
Пример 2. Электролиз расплава NaOH
NaOH Na+ + ОН⎺
Слайд 7
Электролиз расплавов
Пример 3. Электролиз расплава Аl2O3
Аl2O3 Аl3+ + АlO33−
Слайд 8
Электролиз водных растворов
Электролиз растворов
Катодные (восстановительные) процессы. На катоде происходит восстановление катионов металлов и водорода или молекул воды. Для растворов кислот: K(−) Н+, Н2О 2Н+ + 2ē Н20. Для растворов солей или щелочей: K(−) Мn+, Н2О. Характер восстановительного процесса зависит от значения стандартного электродного потенциала металла:
Li, Cs, K, Ba, Ca, Na, Mg, Al.Mn, Zn, Cr, Fe, Co, Ni, Pb.Bi, Cu, Ag, Hg, Pt, Au
Катионы этих металлов не восстанавливаются, восстановлению подвергаются молекулы воды
2Н2О + 2ē Н2 + ОН⎺.Катионы этих металлов восстанавливаются одновременно с молекулами воды, поэтому на катоде одновременно выделяются и Н2 и металл.Катионы этих металлов легко и полностью восстанавливаются на катоде
Слайд 9
Электролиз водных растворов
Анодные (окислительные) процессы. При электролизе растворов используют растворимые и нерастворимые аноды. Нерастворимые аноды изготавливают из углерода или платины, а растворимые – из цинка, меди, никеля и других металлов. На нерастворимом аноде происходит окисление анионов или молекул воды.
Cl⎺, Br⎺, I⎺, S2−, CN⎺.PO43−, CO32−, SO42−, NO3⎺, NO2⎺, ClO4⎺, F⎺
Анионы кислот, не содержащих атомов кислорода (за исключением F⎺), легко окисляются:
2Cl⎺ – 2ē Cl2.Анионы кислородсодержащих кислот не окисляются. Окисляются молекулы воды:
2Н2О – 4ē О2 + 4Н+
Слайд 10
Электролиз водных растворов
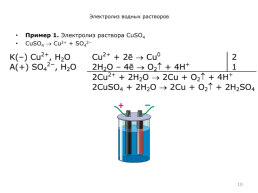
Пример 1. Электролиз раствора CuSO4
CuSO4 Cu2+ + SO42−
Слайд 11
Электролиз водных растворов
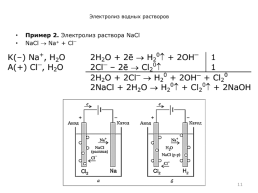
Пример 2. Электролиз раствора NaСl
NaСl Na+ + Сl⎺
Слайд 12
Электролиз водных растворов и расплавов солей
Слайд 13
Электролиз водных растворов и расплавов солей
Слайд 14
Электролиз водных растворов и расплавов солей
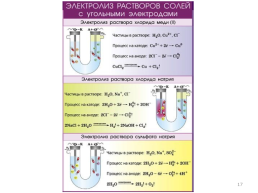
Пример 3. Электролиз раствора Na2SO4.
Na2SO4 2Na+ + SO42−
Слайд 15
Электролиз водных растворов и расплавов солей
Пример 4. Электролиз раствора Na2S
Na2S 2Na+ + S2−
Слайд 16
Электролиз водных растворов и расплавов солей
Пример 5. Электролиз раствора CH3COONa
CH3COONa Na+ + CH3COO−
Слайд 18
Электролиз водных растворов
Растворимый анод при электролизе сам подвергается окислению, т.е. направляет электроны во внешний круг. При отдаче электронов смещается равновесие между электродом и раствором и электрод растворяется:
Пример 4. Электролиз раствора CuSO4 с использованием медного анода.
CuSO4 Cu2+ + SO42−
Слайд 20

Электролиз водных растворов
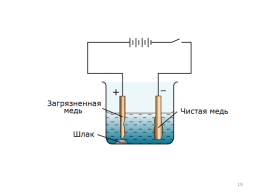
Использование электролиза Окислительная и восстановительная способность электрического тока намного сильнее, чем у химических окислителей и восстановителей. Поэтому электролизом получают наиболее активные металлы (калий, натрий, кальций, магний, алюминий), и менее активные (цинк, медь, кадмий и т.д.). Восстановленные на катоде металлы характеризуются очень высокой чистотой. Применяют электролиз и для очистки некоторых металлов от примесей (электролитическое рафинирование), например меди, никеля, свинца, золота.
Электролизом получают активные неметаллы (хлор, фтор) и такие важные соединения, как натрий гидроксид, калий гидроксид, калий хлорат, пероксид водорода.
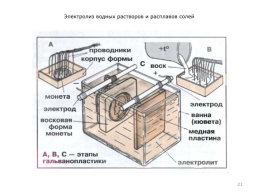
Электролиз применяют также для нанесения защитных металлических покрытий на поверхности (гальванопластика) и изготовление копий рельефных поверхностей (гальваностегия, электрохимическая обработка). Например, хромирование деталей машин, золочение ювелирных изделий.
Электролизом сточных промышленных вод обеспечивается их очистка от катионов металлов-загрязнителей, которые восстанавливаются на катоде.
Слайд 21
Электролиз водных растворов и расплавов солей
Слайд 22
Электролиз водных растворов и расплавов солей
 Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр»
Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр» Растворы электролитов
Растворы электролитов Вводный урок по истории Cредних веков. 6-й класс
Вводный урок по истории Cредних веков. 6-й класс Земноводные
Земноводные Водные богатства
Водные богатства Урок-игра «Рыбы, земноводные и пресмыкающиеся»
Урок-игра «Рыбы, земноводные и пресмыкающиеся» Слитное и раздельное написание производных предлогов
Слитное и раздельное написание производных предлогов