Презентация - Электрохимические производства
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 93%
- Слайдов: 33
- Просмотров: 3130
- Скачиваний: 971
- Размер: 1.8 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Технология производство продуктовых изделий из круп и бобов
Технология производство продуктовых изделий из круп и бобов История возникновения и развития зеркального производства
История возникновения и развития зеркального производства Общие сведения о ДСП - Сырьё для производства
Общие сведения о ДСП - Сырьё для производства Конфиденциальное делопроизводство
Конфиденциальное делопроизводство Производство: затраты, выручка, прибыль
Производство: затраты, выручка, прибыль Современные производственные технологии на занятиях производственного обучения
Современные производственные технологии на занятиях производственного обучения Факторы производства и факторные доходы
Факторы производства и факторные доходы
Слайды и текст этой онлайн презентации
Слайд 1

Электрохимические производства
Электрожизнь везде кипит, По венам ток один бежит…
Электрожизнь везде кипит, По венам ток один бежит…
Слайд 2

Электрохимические производства
Производство натрия Производство NaOH, Cl2, H2 Производство алюминия Производство Н2
Производство натрия Производство NaOH, Cl2, H2 Производство алюминия Производство Н2
Слайд 3

Производство натрия
История Электролитический способ промышленного получения натрия был разработан в 1890 г. Электролизу подвергали расплав NaOH. В этом процессе наряду с натрием выделяется кислород: катод (железный): Na+ + ē = Na анод (никелевый): 4OH⎺ – 4ē = O2 + 2H2O. Сырье Хлорид натрия с добавками, понижающими температуру расплава. При электролизе чистого NaCl возникают серьезные проблемы, связанные, во-первых, с близкими температурой плавления NaCl и температурой кипения натрия и, во-вторых, с высокой растворимостью натрия в жидком NaCl. Добавление к NaCl хлорида калия, фторида натрия, хлорида кальция позволяет снизить температуру расплава до 600°С.
История Электролитический способ промышленного получения натрия был разработан в 1890 г. Электролизу подвергали расплав NaOH. В этом процессе наряду с натрием выделяется кислород: катод (железный): Na+ + ē = Na анод (никелевый): 4OH⎺ – 4ē = O2 + 2H2O. Сырье Хлорид натрия с добавками, понижающими температуру расплава. При электролизе чистого NaCl возникают серьезные проблемы, связанные, во-первых, с близкими температурой плавления NaCl и температурой кипения натрия и, во-вторых, с высокой растворимостью натрия в жидком NaCl. Добавление к NaCl хлорида калия, фторида натрия, хлорида кальция позволяет снизить температуру расплава до 600°С.
Слайд 4

Производство натрия
Производство натрия электролизом расплавленной эвтектической смеси (сплав двух веществ с самой низкой температурой плавления) 40% NaCl и 60% CaCl2 при ~580°С в ячейке, разработанной американским инженером Г.Даунсом, было начато в 1921 Дюпоном вблизи электростанции у Ниагарского водопада. Производство Суммарная реакция: 2NaCl + СаCl2 = 2Na + Ca + 2Cl2 На электродах протекают следующие процессы: катод (железный): Na+ + ē = Na, Ca2+ + 2ē = Ca анод (графитовый): 2Cl⎺ – 2ē = Cl2. Металлические натрий и кальций образуются на цилиндрическом стальном катоде и поднимаются с помощью охлаждаемой трубки, в которой кальций затвердевает и падает обратно в расплав. Хлор, образующийся на центральном графитовом аноде, собирается под никелевым сводом и затем очищается.
Производство натрия электролизом расплавленной эвтектической смеси (сплав двух веществ с самой низкой температурой плавления) 40% NaCl и 60% CaCl2 при ~580°С в ячейке, разработанной американским инженером Г.Даунсом, было начато в 1921 Дюпоном вблизи электростанции у Ниагарского водопада. Производство Суммарная реакция: 2NaCl + СаCl2 = 2Na + Ca + 2Cl2 На электродах протекают следующие процессы: катод (железный): Na+ + ē = Na, Ca2+ + 2ē = Ca анод (графитовый): 2Cl⎺ – 2ē = Cl2. Металлические натрий и кальций образуются на цилиндрическом стальном катоде и поднимаются с помощью охлаждаемой трубки, в которой кальций затвердевает и падает обратно в расплав. Хлор, образующийся на центральном графитовом аноде, собирается под никелевым сводом и затем очищается.
Слайд 5
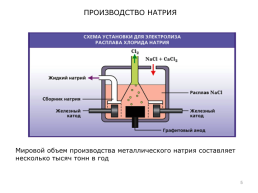
ПРОИЗВОДСТВО НАТРИЯ
Мировой объем производства металлического натрия составляет несколько тысяч тонн в год
Мировой объем производства металлического натрия составляет несколько тысяч тонн в год
Слайд 6
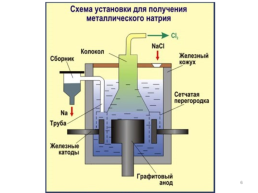
ПРОИЗВОДСТВО НАТРИЯ
Слайд 7

Производство натрия
Применение Промышленное использование металлического натрия связано с его сильными восстановительными свойствами. Долгое время большая часть производимого металла использовалась для получения тетраэтилсвинца PbEt4 и тетраметилсвинца PbMe4 (антидетонаторов для бензина) реакцией алкилхлоридов со сплавом натрия и свинца при высоком давлении. Сейчас это производство быстро сокращается из-за загрязнения окружающей среды. Еще одна область применения – производство титана, циркония и других металлов восстановлением их хлоридов. Меньшие количества натрия используются для получения соединений, таких как гидрид, пероксид и алкоголяты. Диспергированный натрий является ценным катализатором при производстве резины и эластомеров.
Применение Промышленное использование металлического натрия связано с его сильными восстановительными свойствами. Долгое время большая часть производимого металла использовалась для получения тетраэтилсвинца PbEt4 и тетраметилсвинца PbMe4 (антидетонаторов для бензина) реакцией алкилхлоридов со сплавом натрия и свинца при высоком давлении. Сейчас это производство быстро сокращается из-за загрязнения окружающей среды. Еще одна область применения – производство титана, циркония и других металлов восстановлением их хлоридов. Меньшие количества натрия используются для получения соединений, таких как гидрид, пероксид и алкоголяты. Диспергированный натрий является ценным катализатором при производстве резины и эластомеров.
Слайд 8

Производство натрия
Растет применение расплавленного натрия в качестве теплообменной жидкости в ядерных реакторах на быстрых нейтронах. Низкая температура плавления натрия, низкая вязкость, малое сечение поглощения нейтронов в сочетании с чрезвычайно высокой теплоемкостью и теплопроводностью делает его (и его сплавы с калием) незаменимым материалом для этих целей. Натрием надежно очищают трансформаторные масла, эфиры и другие органические вещества от следов воды, а с помощью амальгамы натрия можно быстро определить содержание влаги во многих соединениях.
Растет применение расплавленного натрия в качестве теплообменной жидкости в ядерных реакторах на быстрых нейтронах. Низкая температура плавления натрия, низкая вязкость, малое сечение поглощения нейтронов в сочетании с чрезвычайно высокой теплоемкостью и теплопроводностью делает его (и его сплавы с калием) незаменимым материалом для этих целей. Натрием надежно очищают трансформаторные масла, эфиры и другие органические вещества от следов воды, а с помощью амальгамы натрия можно быстро определить содержание влаги во многих соединениях.
Слайд 9

Производство гидроксида натрия
История Врач герцога Орлеанского Никола Леблан (Leblanc Nicolas) (1742–1806) в 1787 г. разработал удобный процесс получения гидроксида натрия из NaCl (патент 1791 г.). Этот первый крупномасштабный промышленный химический процесс стал крупным технологическим достижением в Европе в 19 в. Позднее процесс Леблана был вытеснен электролитическим процессом. В 1874 г. мировое производство гидроксида натрия составило 525 тыс. т, из которых 495 тыс. т были получены по способу Леблана; к 1902 производство гидроксида натрия достигло 1800 тыс. т., однако по способу Леблана были получены только 150 тыс. т. Сырье Хлорид натрия
История Врач герцога Орлеанского Никола Леблан (Leblanc Nicolas) (1742–1806) в 1787 г. разработал удобный процесс получения гидроксида натрия из NaCl (патент 1791 г.). Этот первый крупномасштабный промышленный химический процесс стал крупным технологическим достижением в Европе в 19 в. Позднее процесс Леблана был вытеснен электролитическим процессом. В 1874 г. мировое производство гидроксида натрия составило 525 тыс. т, из которых 495 тыс. т были получены по способу Леблана; к 1902 производство гидроксида натрия достигло 1800 тыс. т., однако по способу Леблана были получены только 150 тыс. т. Сырье Хлорид натрия
Слайд 10

Производство гидроксида натрия
Производство Сегодня гидроксид натрия – наиболее важная щелочь в промышленности. Ежегодное производство только в США превышает 10 млн. т. Ее получают в огромных количествах электролизом рассолов. При электролизе раствора хлорида натрия образуется гидроксид натрия и выделяется хлор: катод (железный) 2H2O + 2ē = H2 + 2OH⎺ анод (графитовый) 2Cl⎺ – 2ē = Cl2 Электролиз сопровождается концентрированием щелочи в огромных выпаривателях. Самый большой в мире (на заводе PPG Inductries' Lake Charles) имеет высоту 41 м и диаметр 12 м.
Производство Сегодня гидроксид натрия – наиболее важная щелочь в промышленности. Ежегодное производство только в США превышает 10 млн. т. Ее получают в огромных количествах электролизом рассолов. При электролизе раствора хлорида натрия образуется гидроксид натрия и выделяется хлор: катод (железный) 2H2O + 2ē = H2 + 2OH⎺ анод (графитовый) 2Cl⎺ – 2ē = Cl2 Электролиз сопровождается концентрированием щелочи в огромных выпаривателях. Самый большой в мире (на заводе PPG Inductries' Lake Charles) имеет высоту 41 м и диаметр 12 м.
Слайд 11

Производство гидроксида натрия
Технологическая схема электролиза хлорида натрия с твёрдым катодом Диафрагменный метод. Полость электролизёра с твёрдым катодом разделена пористой перегородкой – диафрагмой – на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения – диафрагменным электролизом. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды – водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь: 2Cl⎺ − 2ē = Сl02, H2O − 2ē − 1/2О2 = H2. При этом прикатодная зона обогащается гидроксидом натрия.
Технологическая схема электролиза хлорида натрия с твёрдым катодом Диафрагменный метод. Полость электролизёра с твёрдым катодом разделена пористой перегородкой – диафрагмой – на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения – диафрагменным электролизом. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды – водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь: 2Cl⎺ − 2ē = Сl02, H2O − 2ē − 1/2О2 = H2. При этом прикатодная зона обогащается гидроксидом натрия.
Слайд 12

Производство гидроксида натрия
Технологическая схема электролиза хлорида натрия с твёрдым катодом Раствор из прикатодной зоны, называемый электролитическим щёлоком, содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42–50% в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат.
Технологическая схема электролиза хлорида натрия с твёрдым катодом Раствор из прикатодной зоны, называемый электролитическим щёлоком, содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42–50% в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат.
Слайд 13

Производство гидроксида натрия
Технологическая схема электролиза хлорида натрия с твёрдым катодом Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Технологическая схема электролиза хлорида натрия с твёрдым катодом Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Слайд 14
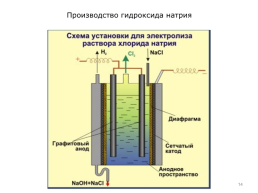
Производство гидроксида натрия
Слайд 15
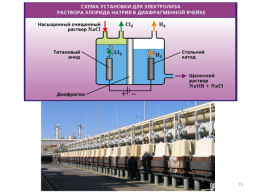
Слайд 16

Производство гидроксида натрия
Мембранный метод – аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
Мембранный метод – аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
Слайд 17

Производство гидроксида натрия
Технологическая схема ртутного электролиза. Основная технологическая стадия – электролиз, основной аппарат – электролитическая ванна, которая состоит из электролизёра, разлагателя и ртутного насоса, объединенных между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды – графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течёт поток анолита – раствор галита. В результате электрохимического разложения галита на аноде образуются ионы Сl⎺ и выделяется хлор: 2Cl⎺ – 2ē = Сl02, который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама: Na+ + ē = Na0 nNa+ + nНg⎺ = Na + Hg
Технологическая схема ртутного электролиза. Основная технологическая стадия – электролиз, основной аппарат – электролитическая ванна, которая состоит из электролизёра, разлагателя и ртутного насоса, объединенных между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды – графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течёт поток анолита – раствор галита. В результате электрохимического разложения галита на аноде образуются ионы Сl⎺ и выделяется хлор: 2Cl⎺ – 2ē = Сl02, который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама: Na+ + ē = Na0 nNa+ + nНg⎺ = Na + Hg
Слайд 18

Производство гидроксида натрия
Технологическая схема ртутного электролиза. Амальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода: Na + Hg + Н2О = NaOH + 1/2Н2 + Hg Полученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Технологическая схема ртутного электролиза. Амальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода: Na + Hg + Н2О = NaOH + 1/2Н2 + Hg Полученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Слайд 19
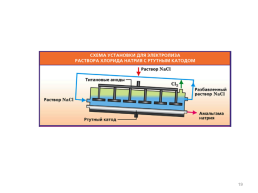
Слайд 20

Производство гидроксида натрия
Применение Около половины производимого гидроксида натрия используется непосредственно в химической промышленности для получения различных органических и неорганических веществ: фенола, резорцина, -нафтола, солей натрия (гипохлорита, фосфата, сульфида, алюминатов). Кроме того, гидроксид натрия применяется в производстве бумаги и пульпы, мыла и моющих средств, масел, текстиля. Он необходим и при переработке бокситов. Важной областью применения гидроксида натрия является нейтрализация кислот.
Применение Около половины производимого гидроксида натрия используется непосредственно в химической промышленности для получения различных органических и неорганических веществ: фенола, резорцина, -нафтола, солей натрия (гипохлорита, фосфата, сульфида, алюминатов). Кроме того, гидроксид натрия применяется в производстве бумаги и пульпы, мыла и моющих средств, масел, текстиля. Он необходим и при переработке бокситов. Важной областью применения гидроксида натрия является нейтрализация кислот.
Слайд 21

Производство алюминия
История В 1854 г. А.Девиль изобрел первый практический способ промышленного производства алюминия. Рост производства был особенно быстрым во время и после Второй мировой войны. Производство первичного алюминия (без учета производства Советского Союза) составляло только 620 тыс. т в 1939, но возросло до1,9 млн. т в 1943. К 1956 во всем мире производилось 3,4 млн. т первичного алюминия; в 1965 мировое производство алюминия составило 5,4 млн. т, в 1980 – 16,1 млн. т, в 1990 – 18 млн. т. Производство алюминия включает три основные стадии: добыча и обогащение руды; получение из руды чистой окиси алюминия (глинозема); восстановление алюминия из окиси путем электролиза.
История В 1854 г. А.Девиль изобрел первый практический способ промышленного производства алюминия. Рост производства был особенно быстрым во время и после Второй мировой войны. Производство первичного алюминия (без учета производства Советского Союза) составляло только 620 тыс. т в 1939, но возросло до1,9 млн. т в 1943. К 1956 во всем мире производилось 3,4 млн. т первичного алюминия; в 1965 мировое производство алюминия составило 5,4 млн. т, в 1980 – 16,1 млн. т, в 1990 – 18 млн. т. Производство алюминия включает три основные стадии: добыча и обогащение руды; получение из руды чистой окиси алюминия (глинозема); восстановление алюминия из окиси путем электролиза.
Слайд 22

Производство алюминия
Добыча и обогащение руды Основная алюминиевая руда – бокситы – добывается главным образом в карьерах; крупнейшими производителями бокситов являются Австралия, Гвинея, Ямайка и Бразилия. Обычно слой руды взрывается для образования рабочей площадки на глубине до 20 м, а потом выбирается. Куски руды дробятся и сортируются с помощью грохотов и классификаторов. Дробленая руда далее обогащается, а пустая порода (хвосты) выбрасывается. На этой стадии процесса экономически выгодно использовать методы промывки и грохочения, использующие разность плотностей руды и пустой породы для отделения их друг от друга. Менее плотная пустая порода уносится промывочной водой, а концентрат оседает на дно обогатительной установки.
Добыча и обогащение руды Основная алюминиевая руда – бокситы – добывается главным образом в карьерах; крупнейшими производителями бокситов являются Австралия, Гвинея, Ямайка и Бразилия. Обычно слой руды взрывается для образования рабочей площадки на глубине до 20 м, а потом выбирается. Куски руды дробятся и сортируются с помощью грохотов и классификаторов. Дробленая руда далее обогащается, а пустая порода (хвосты) выбрасывается. На этой стадии процесса экономически выгодно использовать методы промывки и грохочения, использующие разность плотностей руды и пустой породы для отделения их друг от друга. Менее плотная пустая порода уносится промывочной водой, а концентрат оседает на дно обогатительной установки.
Слайд 23

Производство алюминия
Процесс Байера. Процесс получения чистой окиси алюминия включает нагревание боксита с едким натром, фильтрование, осаждение гидроокиси алюминия и ее прокаливание для выделения чистого глинозема. На практике руда смешивается с нужным количеством горячего едкого натра в автоклаве из низкоуглеродистой стали, и смесь прокачивается через ряд стальных сосудов с паровой рубашкой. В сосудах поддерживается давление пара 1,4–3,5 МПа в течение времени от 40 мин до нескольких часов, пока не завершится переход окиси алюминия из боксита в раствор алюмината натрия в перегретой жидкости. После охлаждения твердый осадок отделяется от жидкости. Жидкость фильтруется; в результате получается пересыщенный чистый раствор алюмината. Этот раствор метастабилен: алюминат-ион разлагается с образованием гидроокиси алюминия.
Процесс Байера. Процесс получения чистой окиси алюминия включает нагревание боксита с едким натром, фильтрование, осаждение гидроокиси алюминия и ее прокаливание для выделения чистого глинозема. На практике руда смешивается с нужным количеством горячего едкого натра в автоклаве из низкоуглеродистой стали, и смесь прокачивается через ряд стальных сосудов с паровой рубашкой. В сосудах поддерживается давление пара 1,4–3,5 МПа в течение времени от 40 мин до нескольких часов, пока не завершится переход окиси алюминия из боксита в раствор алюмината натрия в перегретой жидкости. После охлаждения твердый осадок отделяется от жидкости. Жидкость фильтруется; в результате получается пересыщенный чистый раствор алюмината. Этот раствор метастабилен: алюминат-ион разлагается с образованием гидроокиси алюминия.
Слайд 24

Производство алюминия
Процесс Байера Добавление в раствор кристаллической гидроокиси алюминия, остающейся от предыдущего цикла, ускоряет разложение. Сухие кристаллы гидроокиси алюминия затем прокаливаются для отделения воды. Получающийся безводный глинозем пригоден для использования в процессе Холла-Эру. По экономическим соображениям в промышленности эти процессы стремятся делать по возможности непрерывными.
Процесс Байера Добавление в раствор кристаллической гидроокиси алюминия, остающейся от предыдущего цикла, ускоряет разложение. Сухие кристаллы гидроокиси алюминия затем прокаливаются для отделения воды. Получающийся безводный глинозем пригоден для использования в процессе Холла-Эру. По экономическим соображениям в промышленности эти процессы стремятся делать по возможности непрерывными.
Слайд 25

Производство алюминия
Электролиз Холла-Эру Заключительная стадия производства алюминия включает его электролитическое восстановление из чистой окиси алюминия, полученной в процессе Байера. Этот способ извлечения алюминия основывается на том (открытом Холлом и Эру) факте, что когда глинозем растворяется в расплавленном криолите, при электролизе раствора выделяется алюминий. Типичный электролизер Холла-Эру представляет собой ванну с расплавленным криолитом 3NaFAlF3 (Na3AlF6) – двойным фторидом натрия и алюминия, в котором растворено 3–5% глинозема, – плавающим на подушке из расплавленного алюминия. Стальные шины, проходящие через подину из углеродистых плит, используются для подачи напряжения на катод, а подвешенные угольные бруски, погруженные в расплавленный криолит, служат анодами.
Электролиз Холла-Эру Заключительная стадия производства алюминия включает его электролитическое восстановление из чистой окиси алюминия, полученной в процессе Байера. Этот способ извлечения алюминия основывается на том (открытом Холлом и Эру) факте, что когда глинозем растворяется в расплавленном криолите, при электролизе раствора выделяется алюминий. Типичный электролизер Холла-Эру представляет собой ванну с расплавленным криолитом 3NaFAlF3 (Na3AlF6) – двойным фторидом натрия и алюминия, в котором растворено 3–5% глинозема, – плавающим на подушке из расплавленного алюминия. Стальные шины, проходящие через подину из углеродистых плит, используются для подачи напряжения на катод, а подвешенные угольные бруски, погруженные в расплавленный криолит, служат анодами.
Слайд 26

Производство алюминия
Рабочая температура процесса близка к 950°С, что значительно выше температуры плавления алюминия. Температура в электролизной ванне регулируется изменением зазора между анодами и катодным металлоприемником, на который осаждается расплавленный алюминий. Для поддержания оптимальной температуры и концентрации глинозема в современных электролизерах применяются сложные системы управления. На производство алюминия расходуется очень много электроэнергии, поэтому энергетический КПД процесса – главная проблема в алюминиевой промышленности. Электродные реакции представляют собой восстановление алюминия из его окиси и окисление углерода до его окиси и двуокиси на анодах. Одна печь дает до 2,2 т алюминия в сутки. Металл сливается раз в сутки (или реже), потом флюсуется и дегазируется в отражательной копильной печи и разливается по формам.
Рабочая температура процесса близка к 950°С, что значительно выше температуры плавления алюминия. Температура в электролизной ванне регулируется изменением зазора между анодами и катодным металлоприемником, на который осаждается расплавленный алюминий. Для поддержания оптимальной температуры и концентрации глинозема в современных электролизерах применяются сложные системы управления. На производство алюминия расходуется очень много электроэнергии, поэтому энергетический КПД процесса – главная проблема в алюминиевой промышленности. Электродные реакции представляют собой восстановление алюминия из его окиси и окисление углерода до его окиси и двуокиси на анодах. Одна печь дает до 2,2 т алюминия в сутки. Металл сливается раз в сутки (или реже), потом флюсуется и дегазируется в отражательной копильной печи и разливается по формам.
Слайд 27

Производство алюминия
Возобновляемые электроды Содерберга В электролизере Холла-Эру угольные аноды расходуются со скоростью 2,5 см/сут, так что часто требуется установка новых анодов. Чтобы исключить частое вмешательство человека в производство, был разработан процесс с использованием возобновляемого электрода Содерберга. Анод Содерберга непрерывно образуется и спекается в восстановительной камере из пасты – смеси 70% молотого кокса и 30% смоляной связки. Эта смесь набивается в прямоугольную оболочку из листовой стали, открытую с обоих концов и расположенную вертикально над ванной с расплавом внутри печи. По мере расходования анода в верхнее отверстие оболочки добавляется паста. Когда коксосмоляная смесь опускается вниз и нагревается, она спекается в твердый углеродистый брусок прежде, чем достигает рабочей зоны.
Возобновляемые электроды Содерберга В электролизере Холла-Эру угольные аноды расходуются со скоростью 2,5 см/сут, так что часто требуется установка новых анодов. Чтобы исключить частое вмешательство человека в производство, был разработан процесс с использованием возобновляемого электрода Содерберга. Анод Содерберга непрерывно образуется и спекается в восстановительной камере из пасты – смеси 70% молотого кокса и 30% смоляной связки. Эта смесь набивается в прямоугольную оболочку из листовой стали, открытую с обоих концов и расположенную вертикально над ванной с расплавом внутри печи. По мере расходования анода в верхнее отверстие оболочки добавляется паста. Когда коксосмоляная смесь опускается вниз и нагревается, она спекается в твердый углеродистый брусок прежде, чем достигает рабочей зоны.
Слайд 28
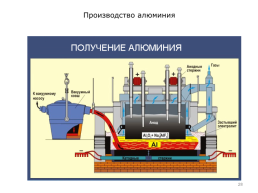
Производство алюминия
Слайд 29

Производство алюминия
АЛЮМИНИЕВЫЙ ЗАВОД в Инвергордоне (Шотландия)
АЛЮМИНИЕВЫЙ ЗАВОД в Инвергордоне (Шотландия)
Слайд 30

Производство алюминия
Потребление алюминия Около 28% производимого алюминия идет на изготовление банок для напитков, пищевой тары и всевозможных упаковок. Еще 17% используется в транспортных средствах, включая самолеты, военную технику, железнодорожные пассажирские вагоны и автомобили. Около 16% применяется в конструкциях зданий. Примерно 8% используется в высоковольтных линиях электропередачи и других электрических устройствах, 7% – в таких потребительских товарах, как холодильники, кондиционеры воздуха, стиральные машины и мебель. На нужды машиностроения и промышленное оборудование расходуется 6%. Остающаяся часть потребляемого алюминия используется в производстве телевизионных антенн, пигментов и красок, космических кораблей и судов.
Потребление алюминия Около 28% производимого алюминия идет на изготовление банок для напитков, пищевой тары и всевозможных упаковок. Еще 17% используется в транспортных средствах, включая самолеты, военную технику, железнодорожные пассажирские вагоны и автомобили. Около 16% применяется в конструкциях зданий. Примерно 8% используется в высоковольтных линиях электропередачи и других электрических устройствах, 7% – в таких потребительских товарах, как холодильники, кондиционеры воздуха, стиральные машины и мебель. На нужды машиностроения и промышленное оборудование расходуется 6%. Остающаяся часть потребляемого алюминия используется в производстве телевизионных антенн, пигментов и красок, космических кораблей и судов.
Слайд 31

Производство водорода
Производство водорода Промышленное производство водорода – неотъемлемая часть водородной энергетики, первое звено в жизненном цикле употребления водорода. Водород практически не встречается в природе в чистой форме и должен быть извлечён из других соединений с помощью различных химических методов. Электролиз воды – энергоёмкий процесс, и в настоящее время процесс получения водорода электролизом в промышленных масштабах имеет ограниченное применение.
Производство водорода Промышленное производство водорода – неотъемлемая часть водородной энергетики, первое звено в жизненном цикле употребления водорода. Водород практически не встречается в природе в чистой форме и должен быть извлечён из других соединений с помощью различных химических методов. Электролиз воды – энергоёмкий процесс, и в настоящее время процесс получения водорода электролизом в промышленных масштабах имеет ограниченное применение.
Слайд 32

Производство водорода
Слайд 33

Производство водорода
Производство водорода Промышленное производство водорода — неотъемлемая часть водородной энергетики, первое звено в жизненном цикле употребления водорода. Водород практически не встречается в природе в чистой форме и должен быть извлечён из других соединений с помощью различных химических методов.
Производство водорода Промышленное производство водорода — неотъемлемая часть водородной энергетики, первое звено в жизненном цикле употребления водорода. Водород практически не встречается в природе в чистой форме и должен быть извлечён из других соединений с помощью различных химических методов.
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
