Презентация - Электросинтез
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 84%
- Слайдов: 9
- Просмотров: 4214
- Скачиваний: 2107
- Размер: 0.22 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей
 Электрохимические производства
Электрохимические производства
 Подготовка к егэ по русскому языку. 16-21 Задания (теория и практика)
Подготовка к егэ по русскому языку. 16-21 Задания (теория и практика)
 Политическая система и политический режим
Политическая система и политический режим
 Пространство
Пространство
 День матери. Открытый классный час
День матери. Открытый классный час
 Уютные книги для зимнего вечера. Виртуальная книжная выставка
Уютные книги для зимнего вечера. Виртуальная книжная выставка
Слайды и текст этой онлайн презентации
Слайд 1

Электросинтез
Единственный путь, ведущий к знанию, – это деятельность. Б. Шоу
Единственный путь, ведущий к знанию, – это деятельность. Б. Шоу
Слайд 2

Электросинтез
ЭЛЕКТРОСИНТЕЗ (электрохимический синтез), способ получения химических соединений в процессе электролиза. В качестве анодов обычно используют оксиды Pb(IV), Ni, Mn(IV) и др. металлов, благородные металлы (Pt, Ir, Ru), графит и его модификации (стеклоуглерод, пирографит). Катодами чаще всего служат Pb, Hg, Cu, Zn, Ni, Fe или др. металлы. Исходное вещество растворяют в полярном растворителе (вода, низшие алифатические спирты, ацетонитрил, ДМФА, диоксан). Наиболее эффективны процессы электросинтеза, если молекулы исходного вещества диссоциируют в растворе на ионы, а также если исходное вещество - органическое соединение, в молекулах которого имеются полярные функциональные группы. Если исходное вещество не является электролитом, необходимо добавление вещества, придающего системе электропроводящие свойства, но не участвующего в электродном процессе (фоновый электролит). Если исходное вещество не растворяется в используемом полярном растворителе (напр., в воде), вводят дополнительный сорастворитель - вещество, растворимое в воде и растворяющее исходное вещество. Этот прием часто используют при электросинтезе органических веществ.
ЭЛЕКТРОСИНТЕЗ (электрохимический синтез), способ получения химических соединений в процессе электролиза. В качестве анодов обычно используют оксиды Pb(IV), Ni, Mn(IV) и др. металлов, благородные металлы (Pt, Ir, Ru), графит и его модификации (стеклоуглерод, пирографит). Катодами чаще всего служат Pb, Hg, Cu, Zn, Ni, Fe или др. металлы. Исходное вещество растворяют в полярном растворителе (вода, низшие алифатические спирты, ацетонитрил, ДМФА, диоксан). Наиболее эффективны процессы электросинтеза, если молекулы исходного вещества диссоциируют в растворе на ионы, а также если исходное вещество - органическое соединение, в молекулах которого имеются полярные функциональные группы. Если исходное вещество не является электролитом, необходимо добавление вещества, придающего системе электропроводящие свойства, но не участвующего в электродном процессе (фоновый электролит). Если исходное вещество не растворяется в используемом полярном растворителе (напр., в воде), вводят дополнительный сорастворитель - вещество, растворимое в воде и растворяющее исходное вещество. Этот прием часто используют при электросинтезе органических веществ.
Слайд 3

Электросинтез
Основные характеристики промышленного электросинтеза следующие: 1) токовая нагрузка на электролизер. Для биполярных электролизеров различают линейную нагрузку Iл - ток в А, который подводится к электролизеру, и эквивалентную нагрузку Iл - n, где n - число электродов. Эквивалентная нагрузка определяет производительность электролизера. максимальная токовая нагрузка в промышленных электролизерах редко превышает 50 кА. 2) Напряжение - разность электрических потенциалов, прикладываемая к клеммам электролизера. Общее напряжение при электросинтезе складывается из падения напряжения в электродах и токоподводящих шинах; теоретическое напряжения разложения для данной электрохимической системы, равного алгебраической разности равновесных потенциалов анода и катода, рассчитываемых по уравнению Нернста; перенапряжения; падения напряжения из-за внутреннего сопротивления электролита (гл. обр. в слое между электродами) и падения напряжения на диафрагме, разделяющей катодное и анодное пространства.
Основные характеристики промышленного электросинтеза следующие: 1) токовая нагрузка на электролизер. Для биполярных электролизеров различают линейную нагрузку Iл - ток в А, который подводится к электролизеру, и эквивалентную нагрузку Iл - n, где n - число электродов. Эквивалентная нагрузка определяет производительность электролизера. максимальная токовая нагрузка в промышленных электролизерах редко превышает 50 кА. 2) Напряжение - разность электрических потенциалов, прикладываемая к клеммам электролизера. Общее напряжение при электросинтезе складывается из падения напряжения в электродах и токоподводящих шинах; теоретическое напряжения разложения для данной электрохимической системы, равного алгебраической разности равновесных потенциалов анода и катода, рассчитываемых по уравнению Нернста; перенапряжения; падения напряжения из-за внутреннего сопротивления электролита (гл. обр. в слое между электродами) и падения напряжения на диафрагме, разделяющей катодное и анодное пространства.
Слайд 4

Электросинтез
3) Плотность тока. Электродная плотность тока выражается отношением тока к площади поверхности контакта электрода с электролитом, на которой происходит электродный процесс (измеряется в А/м2). Промышленный электросинтез ведется при плотностях тока от 500 до 3000 А/см2. Объемная плотность тока измеряется в А на 1 л раствора электролита и характеризуется совершенством конструкции электролизера. 4) Выход по току (в %) характеризует долю тока, которая расходуется на получение целевого продукта. 5) Коэффициент полезного использования электроэнергии - отношение теоретически необходимого количества электроэнергии для получения единицы массы вещества к практически затраченному, Теоретически необходимое кол-во электроэнергии W0 равно энергии, которую нужно затратить при протекании электросинтеза со 100%-ным выходом по току при напряжении, равном напряжению разложения.
3) Плотность тока. Электродная плотность тока выражается отношением тока к площади поверхности контакта электрода с электролитом, на которой происходит электродный процесс (измеряется в А/м2). Промышленный электросинтез ведется при плотностях тока от 500 до 3000 А/см2. Объемная плотность тока измеряется в А на 1 л раствора электролита и характеризуется совершенством конструкции электролизера. 4) Выход по току (в %) характеризует долю тока, которая расходуется на получение целевого продукта. 5) Коэффициент полезного использования электроэнергии - отношение теоретически необходимого количества электроэнергии для получения единицы массы вещества к практически затраченному, Теоретически необходимое кол-во электроэнергии W0 равно энергии, которую нужно затратить при протекании электросинтеза со 100%-ным выходом по току при напряжении, равном напряжению разложения.
Слайд 5

Электросинтез
Электросинтез неорганических веществ. Промышленное получение неорганических окислителей основано главным образом на анодном процессе (электроокислении), катодные процессы находят ограниченное применение. Анодные процессы проводят, как правило, в бездиафрагменных электролизерах, используя в качестве катодов сталь. Для подавления нежелательных процессов восстановления в раствор добавляют дихромат натрия; образующаяся на катоде хромит-хроматная пленка предотвращает восстановительные процессы. В промышленности применяют электросинтез для получения надсерной (пероксодисерной) кислоты H2S2O8 и ее солей - персульфатов; способ основан на электроокислении серной кислоты и сульфатов. Надсерная кислота и некоторые ее соли используются в производстве пероксида водорода. Перманганат калия KМnО4 получают электроокислением манганата K2МnО4 или анодным растворением сплава Мn с Fe - ферромарганца. Диоксид марганца МnО2 в значит. масштабах производится электролизом сернокислых растворов сульфата марганца MnSO4. Путем электроокисления синтезируют кислородсодержащие соединения хлора в различных степенях окисления и др. продукты.
Электросинтез неорганических веществ. Промышленное получение неорганических окислителей основано главным образом на анодном процессе (электроокислении), катодные процессы находят ограниченное применение. Анодные процессы проводят, как правило, в бездиафрагменных электролизерах, используя в качестве катодов сталь. Для подавления нежелательных процессов восстановления в раствор добавляют дихромат натрия; образующаяся на катоде хромит-хроматная пленка предотвращает восстановительные процессы. В промышленности применяют электросинтез для получения надсерной (пероксодисерной) кислоты H2S2O8 и ее солей - персульфатов; способ основан на электроокислении серной кислоты и сульфатов. Надсерная кислота и некоторые ее соли используются в производстве пероксида водорода. Перманганат калия KМnО4 получают электроокислением манганата K2МnО4 или анодным растворением сплава Мn с Fe - ферромарганца. Диоксид марганца МnО2 в значит. масштабах производится электролизом сернокислых растворов сульфата марганца MnSO4. Путем электроокисления синтезируют кислородсодержащие соединения хлора в различных степенях окисления и др. продукты.
Слайд 6
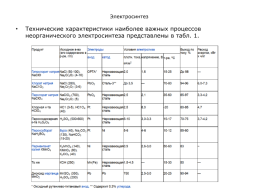
Электросинтез
Технические характеристики наиболее важных процессов неорганического электросинтеза представлены в табл. 1.
Технические характеристики наиболее важных процессов неорганического электросинтеза представлены в табл. 1.
Слайд 7

Электросинтез
Электросинтез органических веществ. В органическом электросинтезе различают процессы прямые и непрямые. В прямых процессах протекает обмен электронами между органическим веществом и электродом с образованием промежуточных ион-радикалов или свободных радикалов, которые вступают в различные химические процессы. На катоде органическое вещество присоединяет электроны, образуя анионы. Если вещество содержит кратную связь, последняя разрывается с образованием анион-радикалов. Эти частицы способны взаимодействовать с протонами, образуя продукты гидрирования, а также димеризоваться и реагировать с нуклеофильными реагентами. Практически те же типы реакций протекают и на аноде, только первичным процессом является отдача электронов, приводящая к возникновению катионов и катион-радикалов, которые взаимодействуют друг с другом (димеризация), с растворителем (анодное замещение) или с присутствующими в растворе электрохимически неактивными веществами (реакции сочетания).
Электросинтез органических веществ. В органическом электросинтезе различают процессы прямые и непрямые. В прямых процессах протекает обмен электронами между органическим веществом и электродом с образованием промежуточных ион-радикалов или свободных радикалов, которые вступают в различные химические процессы. На катоде органическое вещество присоединяет электроны, образуя анионы. Если вещество содержит кратную связь, последняя разрывается с образованием анион-радикалов. Эти частицы способны взаимодействовать с протонами, образуя продукты гидрирования, а также димеризоваться и реагировать с нуклеофильными реагентами. Практически те же типы реакций протекают и на аноде, только первичным процессом является отдача электронов, приводящая к возникновению катионов и катион-радикалов, которые взаимодействуют друг с другом (димеризация), с растворителем (анодное замещение) или с присутствующими в растворе электрохимически неактивными веществами (реакции сочетания).
Слайд 8

Электросинтез
Молекулы органических соединений во многих случаях не обладают достаточной реакционной способностью и не вступают в реакции на электродах. Электросинтез с участием таких веществ проводят т.наз. непрямым электровосстановлением или электроокислением, осуществляемыми в объеме раствора в присутствии катализаторов-переносчиков (медиаторов) - солей переходных металлов, кислородсодержащих анионов. Роль электролиза в данном случае сводится к регенерации на электродах хим. восстановителя или окислителя, которые превращают исходное вещество в целевой продукт. Основные процессы органического электросинтеза и их технические характеристики представлены в табл. 2. Органический электросинтез наиболее целесообразен для организации малотоннажных производств (фармацевтических препаратов, душистых веществ, химикатов для фотографии и др.).
Молекулы органических соединений во многих случаях не обладают достаточной реакционной способностью и не вступают в реакции на электродах. Электросинтез с участием таких веществ проводят т.наз. непрямым электровосстановлением или электроокислением, осуществляемыми в объеме раствора в присутствии катализаторов-переносчиков (медиаторов) - солей переходных металлов, кислородсодержащих анионов. Роль электролиза в данном случае сводится к регенерации на электродах хим. восстановителя или окислителя, которые превращают исходное вещество в целевой продукт. Основные процессы органического электросинтеза и их технические характеристики представлены в табл. 2. Органический электросинтез наиболее целесообразен для организации малотоннажных производств (фармацевтических препаратов, душистых веществ, химикатов для фотографии и др.).
Слайд 9
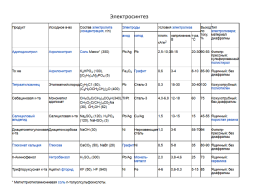
Электросинтез
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
