Презентация - Растворы электролитов
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 82%
- Слайдов: 64
- Просмотров: 5871
- Скачиваний: 2801
- Размер: 0.06 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр»
Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр» Электролитическая диссоциация
Электролитическая диссоциация Вода - растворитель
Вода - растворитель Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Растворение. Кристаллогидраты
Растворение. Кристаллогидраты Электролитическая диссоциация
Электролитическая диссоциация Вода - лучший растворитель на Земле
Вода - лучший растворитель на Земле
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 6 Растворы электролитов
Слайд 2

План 6.1 Теория электролитической диссоциации С. Аррениуса 6.2 Теории слабых и сильных электролитов 6.3 Электропроводность растворов электролитов 6.4 Роль электролитов в жизнедеятельности организма
Слайд 3

6.1 Электролиты – это вещества, способные в растворах и расплавах диссоциировать на ионы. К ним относятся соединения с ионным и ковалентным полярным типом связи: соли, кислоты, основания, вода.
Слайд 4

Самопроизвольный распад электролитов на ионы, протекающий под воздействием растворителя, называется электролитической диссоциацией, теория которой была создана в 1884-1887 г.г. шведским ученым С. Аррениусом.
Слайд 5

Сванте Аррениус (1859-1927) Шведский физико - химик, основные работы которого посвящены учению о растворах электролитов и кинетике химических реакций. Лауреат Нобелевской премии (1903)
Слайд 6

Основные положения теории С. Аррениуса 1. В растворах электролитов происходит самопроизвольный распад (диссоциация) молекул на ионы, в результате чего раствор становится электропроводным.
Слайд 7

Степень диссоциации электролита (α) определяет электропроводность раствора: число молекул, распавшихся на ионы α ------------------------------------------- общее число молекул растворенного вещества
Слайд 8

2. Осмотическое давление, температура кипения и плавления, а также другие свойства растворов, зависят не только от их концентрации, но и от степени диссоциации электролитов : α
Слайд 9

где n - число ионов, на которые распадается молекула электролита: Na Cl n 2 Na 2 SO 4 n 3 Na 3 PO 4 n 4
Слайд 10

i – изотонический коэффициент (коэффициент Вант-Гоффа); в бесконечно разбавленных растворах если α 1, то i n
Слайд 11

3. Электролиты, в зависимости от степени их диссоциации, делятся на сильные и слабые .
Слайд 12

Однако это деление условно, т.к. одно и тоже вещество, в зависимости от природы растворителя, может быть как сильным, так и слабым электролитом.
Слайд 13

Na C l в воде – сильный электролит, Na C l в бензоле – слабый электролит В дальнейшим будут рассмотрены только водные растворы электролитов.
Слайд 14

Современные воззрения на процесс электролитической диссоциации объединяют идеи Аррениуса и учение Д. И. Менделеева о растворе, как химической системе продуктов взаимодействия растворенного вещества и растворителя.
Слайд 15
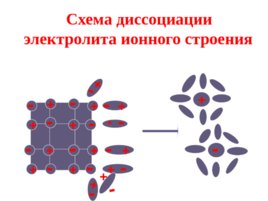
Схема диссоциации электролита ионного строения - - - - - - - - - - - - - - - -
Слайд 16

Экспериментальным путем определяются числа гидратации , показывающие, сколько молекул воды связано с одним ионом: H Li Na NH 4 K Rb Cs 1 120 66 17 16 14 13
Слайд 17

Роль растворителя в процессе диссоциации описывается законом Кулона : q 1 q 2 r 2 F
Слайд 18

где F – сила электростатического притяжения ионов, q 1 и q 2 – заряды ионов, r – расстояние между ними,
Слайд 19

– диэлектрическая постоянная растворителя , показывающая во сколько раз взаимодействие между ионами в данной среде меньше, чем в вакууме.
Слайд 20

(H 2 O) 81; (C 2 H 5 OH) 24, для большинства орг. растворителей 2-2,5.
Слайд 21

В воде сила взаимодействия между ионами понижается в 80 раз, и собственные колебания частиц в узлах кристаллической решетки ведут к ее разрушению.
Слайд 22

Вода является лучшей средой для диссоциации электролитов .
Слайд 23

6 .2.1 Теория слабых электролитов К слабым электролитам относятся ковалентные соединения, обратимо (частично) диссоциирующие в водных растворах.
Слайд 24

К ним относятся : а) почти все органические и многие неорганические кислоты: H 2 S, H 2 SO 3 , HNO 2 , HCN, и др; б)труднорастворимыи основания, а также NH 4 OH в) некоторые соли Hg C l 2 , Fe(CNS) 3 ; г) вода.
Слайд 25

В растворах слабых электролитов устанавливается равновесие между молекулами веществ и их ионами: Ka т A н Ka т A н - α 1
Слайд 26

Данные равновесия описываются с помощью констант равновесия, называемых константами диссоциации (К дис ) .
Слайд 27
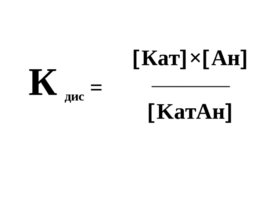
К дис К a т A н Ka т A н
Слайд 28

Частными случаями К дис являются: константы кислотности К а , константы основности К b , константы нестойкости К н , (характеризует диссоциацию комплексных соединений)
Слайд 29

Слабые электролиты подчиняются закону разбавления Оствальда , получившего Нобелевскую премию в 1909 за работы в области химического равновесия. Ф. В. Оствальд ( 1853-1932 )
Слайд 30

При разбавление раствора водой степень электролитической диссоциации электролита увеличивается : 2 1 – α К дис С м
Слайд 31
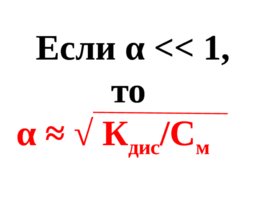
Если α α К дис /С м
Слайд 32

6.2.2 Теория сильных электролитов Дебая-Гюккеля (1923) Сильными электролитами называются соединения с ионным или ковалентным полярным типом связи, необратимо диссоциирующие в водных растворах
Слайд 33

К сильным электролитам относятся: Некоторые неорганические кислоты: HCl, HCl O 4 , HNO 3 , H 2 SO 4 и др., Щелочи: Na OH, KOH, Ba(OH) 2 , Ca(OH) 2 и др., Соли
Слайд 34

Ka т A н Ka т A н - 1
Слайд 35

Из-за высокой концентрации ионов в растворе сильного электролита создается собственное электромагнитное поле, интенсивность которого определяется величиной ионной силы раствора (I) ; I
Слайд 36
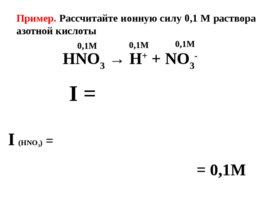
Пример. Рассчитайте ионную силу 0,1 М раствора азотной кислоты HNO 3 H NO 3 - 0 , 1M I I (HNO 3 ) 0,1M 0,1M 0,1M
Слайд 37

В растворе сильного электролита вокруг каждого иона создается ионная атмосфера , состоящая из ионов противоположного знака: - - - - - - - Плотность атмосферы зависит от концентрации раствора
Слайд 38
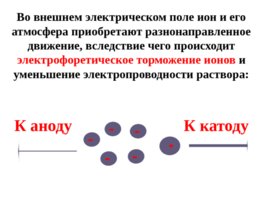
Во внешнем электрическом поле ион и его атмосфера приобретают разнонаправленное движение, вследствие чего происходит электрофоретическое торможение ионов и уменьшение электропроводности раствора: - - - - - К катоду К аноду
Слайд 39

Из-за уменьшения электропроводности, вызванной взаимным торможением ионов, создается впечатление, что концентрация ионов в растворе меньше, чем истинная. Эта «кажущаяся» концентрация называется активностью (а) .
Слайд 40

а γ С м где γ – коэффициент активности иона, характеризующий отклонение физических свойств растворов от идеальных свойств ( γ ) .
Слайд 41

В растворах сильных электролитов ионы проявляют свои свойства не в соответствии с их концентрацией, а в соответствии с их активностью .
Слайд 42

6.3 Растворы электролитов являются проводниками второго рода; тип проводимости ионный. Если в раствор электролита опустить электроды и подключить к источнику постоянного тока, то ионы приобретут направленное движение: катионы будут перемещаться к катоду, а анионы - к аноду.
Слайд 43

Электропроводность растворов при постоянной температуре зависит от количества ионов и их подвижности (U) , т.е. скорости перемещения к электродам при напряжении тока 1В. æ С м ( U U - ), где æ – удельная электропроводность, Ом 1 м 1 .
Слайд 44
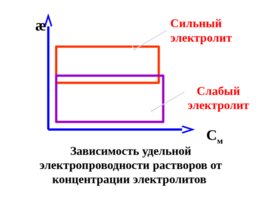
æ Зависимость удельной электропроводности растворов от концентрации электролитов С м Сильный электролит Слабый электролит
Слайд 45

В области разбавленных растворов рост концентрации приводит к увеличению электропроводности , что связано с увеличением числа ионов; в области концентрированных растворов увеличение концентрации приводит к уменьшению электропроводности.
Слайд 46

Для слабых электролитов данная зависимость обусловлена уменьшением степени диссоциации (закон Оствальда); для сильных – усилением электрофоретического торможения ионов и уменьшением их подвижности.
Слайд 47

Органы и ткани организма электропроводны, т.к. содержат растворенные электролиты. Изменение проводимости тканей и клеток свидетельствует о протекании патологических процессов.
Слайд 48
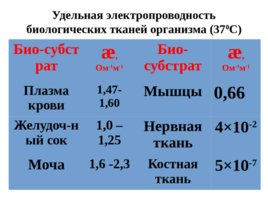
Био-субстрат æ , Ом -1 м -1 Био- субстрат æ , Ом -1 м -1 Плазма крови 1,47- 1,60 Мышцы 0,66 Желудоч - ный сок 1,0 – 1,25 Нервная ткань 4 10 -2 Моча 1,6 -2,3 Костная ткань 5 10 -7 Удельная электропроводность биологических тканей организма (37 0 С)
Слайд 49

При заболеваниях почек удельная электропроводность мочи может уменьшаться до 0,9 -1,4 Ом -1 м -1 , что связано с уменьшением концентрации Na Cl и увеличением содержания белка.
Слайд 50

При диабете электропроводность мочи также уменьшается из-за повышенного содержания сахара, являющегося неэлектролитом.
Слайд 51

Электрическая проводимость тканей лежит в основе таких физиотерапевтических методов лечения как ионофорез, электростимуляция, ультравысокочастотная терапия .
Слайд 52

Для физико-химических исследований широко применяется молярная электропроводность растворов ( λ ): λ æ С м
Слайд 53

λ α (U U - ) При бесконечно большом разбавлении раствора α 1 и λ U U - где – знак бесконечного большого разбавления раствора.
Слайд 54
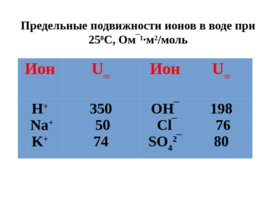
Ион U Ион U Н Na K 350 50 74 OH C l SO 4 2 198 76 80 Предельные подвижности ионов в воде при 25 0 С, Ом 1 м 2 /моль
Слайд 55

По данным электропроводности можно определить степень диссоциации электролитов ( ) и растворимость труднорастворимых электролитов (S): λ æ – æ ( H 2 O ) ----; S --------- λ λ
Слайд 56

6.4 Электролиты играют важную роль в жизнедеятельности организма. Общее содержание катионов в плазме крови 154 ммоль/л. К важнейшим катионам относятся Na , K , Ca 2 , Mg 2 .
Слайд 57

Общее содержание анионов в плазме 154 ммоль/л. К важнейшим анионам относятся Cl - , HCO 3 - , SO 4 2- , H 2 PO 4 - , HPO 4 2- , а также макроанионы белков.
Слайд 58

Ионная сила плазмы крови составляет 0,15 моль/л. Каждый ион выполняет свои особые функции и, кроме того, существуют общие функции электролитов в организме .
Слайд 59

а) удерживают воду в виде гидратов; б) создают осмотическое давление биологических жидкостей. Существование перепадов осмотического давления является причиной активного транспорта воды; Электролиты в организме:
Слайд 60

в ) влияют на растворимость газов, а также белков, аминокислот и других органических соединений.
Слайд 61

В разбавленных растворах наблюдается солевой эффект – увеличение растворимости веществ в присутствии электролитов;
Слайд 62

В концентрированных растворах имеет место эффект высаливания – уменьшение растворимости веществ в присутствии электролитов.
Слайд 63
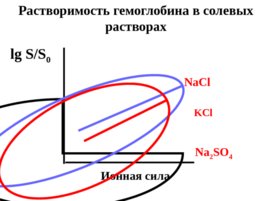
Na Cl KCl Na 2 SO 4 Ионная сила lg S/S 0 Растворимость гемоглобина в солевых растворах
Слайд 64

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
