Слайды и текст этой онлайн презентации
Слайд 1
Растворение
Кристаллогидраты Химическая сборная лицея 1502 при МЭИ Тренер Назаров М. А. 8 класс Москва, 2019
Слайд 2
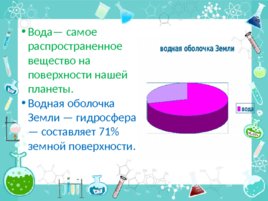
Вода— самое распространенное вещество на поверхности нашей планеты. Водная оболочка Земли — гидросфера— составляет 71% земной поверхности.
Слайд 3
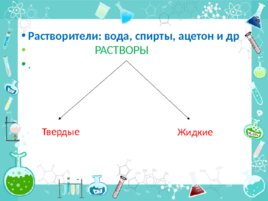
Растворители: вода, спирты, ацетон и др РАСТВОРЫ . Жидкие Твердые
Слайд 4
Теория растворов Физическая теория Химическая теория Растворение – это результат диффузии. Растворы – это однородные смеси. (Вант-Гофф, Аррениус, Растворы – Оствальд) Растворение- это химическое взаимодействие растворенного вещества с водой называемое гидратацией. Растворы- это химическое соединения гидраты. (Менделеев, Каблуков, Кистяковский)
Слайд 5
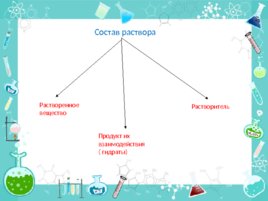
Состав раствора Растворенное вещество Продукт их взаимодействия ( гидраты) Растворитель
Слайд 7
Признаки химического взаимодействия при растворении Тепловые явления, так же, как в случае химических реакций наблюдаются экзо- и эндотермические эффекты. Выделение тепла наблюдается в случае растворения Н2SO4, Na OH, Ag NO3, Zn SO4. Поглощение тепла наблюдается в случае растворения NН4NO3, Na NO3, KCl, K2SO4, KNO2, NH4Cl. Изменение цвета: Cu SO4 – белого цвета, при растворении в воде – голубого, продукт взаимодействия сульфата меди с водой так же синего цвета Cu2SO4 5H2O.
Слайд 12
Насыщенные - такие растворы, в которых при данной температуре вещество больше не растворяется. Ненасыщенные - такие растворы, в которых при данной температуре находится меньше растворенного вещества, чем в его насыщенном растворе. Пересыщенные -такие растворы, в которых при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. Растворы
Слайд 15
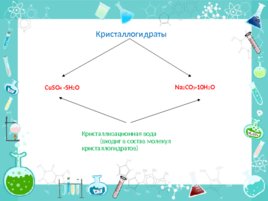
Кристаллогидраты Cu SO 4 5H 2 O Na 2 CO 3 10H 2 O Кристаллизационная вода (входит в состав молекул кристаллогидратов)
Слайд 16
Сульфат меди безводный Cu SO 4 и кристаллогидрат Cu SO 4 5H 2 O (медный купорос)
Слайд 18
Карбонат натрия безводный Na 2 CO 3 и
кристаллогидрат Na 2 CO 3 10Н 2 О (сода кальцинированная)
Слайд 21
I. Задачи на определение формул. 1.(Районная олимпиада по химии-2007 год; 9 класс). Установите формулу кристаллогидрата сульфата железа (II), если известно, что эта соль содержит 45,32 % воды по массе. 2.(Кузьменко Н. Е., Еремин В. В. 2500 задач по химии) Выведите формулу кристаллогидрата сульфата натрия, если известно, что массовая доля кристаллизационной воды в нем равна 55,9%. 3.(Подготовительные курсы ЛХФИ -1981 год) Найти формулу кристаллогидрата хлорида бария зная, что 36,6 г соли при прокаливании теряют в массе 5,4 г. 4.(Подготовительные курсы ИГМА) При прокаливании 2,42 г кристаллогидрата нитрата меди (II) масса вещества уменьшилась на 1,62 г. Установите формулу кристаллогидрата.
Слайд 22
II. Задачи на растворы 1. Определите массовую долю сульфата железа (II) в растворе, полученном при растворении 55,6 г семиводного кристаллогидрата в 344,4 г воды. 2. Определите количество кристаллогидрата Mg Сl2 6H2О, которое нужно растворить в 159,4 г воды, чтобы получить 10%-ный раствор хлорида магния. 3. Определите количество воды, в котором надо растворить 27,8 г семиводного сульфата железа (II), чтобы получить насыщенный при 50 С раствор сульфата железа (II) (растворимость соли при этой температуре 48,6 г в 100 г воды). 4. Какую массу кристаллогидрата сульфата натрия можно получить при выпаривании 400 мл 12%-ного раствора плотностью 1,12 г/мл?
 Практическая работа «Приготовление раствора с определенной массовой долей Растворенного Вещества»
Практическая работа «Приготовление раствора с определенной массовой долей Растворенного Вещества» Растворение - Растворимость веществ в воде
Растворение - Растворимость веществ в воде Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр»
Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр»
 Комплексные соединения (Сборная лицейчика)
Комплексные соединения (Сборная лицейчика)
 Владимирская икона Божией Матери
Владимирская икона Божией Матери
 Формы правления государства
Формы правления государства
 Спиной мозг
Спиной мозг