Презентация - Коллигативные свойства растворов
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 93%
- Слайдов: 52
- Просмотров: 6893
- Скачиваний: 3051
- Размер: 1.64 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр»
Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов, ионные уравнения, овр» Физико-химические свойства растворов
Физико-химические свойства растворов Белки (свойства и функции)
Белки (свойства и функции) Сочетательное свойство умножения
Сочетательное свойство умножения Свойства живого
Свойства живого Биология - наука о жвом мире - Общие свойства живых организмов
Биология - наука о жвом мире - Общие свойства живых организмов Прямоугольные треугольники и некоторые их свойства
Прямоугольные треугольники и некоторые их свойства
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 5
Коллигативные свойства растворов
Слайд 2

План 5.1 Первый закон Рауля 5.2 Эбулиоскопический закон Рауля 5.3 Криоскопический закон Рауля 5.4 Осмос. Осмотическое давление
Слайд 3

Коллигативными (общими) называются свойства растворов, зависящие только от их концентрации, точнее от соотношения числа частиц растворителя и растворенного вещества. Коллигативные свойства не зависят от природы веществ.
Слайд 4

Важнейшими коллигативными свойствами растворов являются: 1) Понижение давления пара над раствором ; 2) Повышение температуры кипения раствора; 3) Понижение температуры замерзания раствора; 4) Осмос и осмотическое давление.
Слайд 5

Франсуа Мари Рауль (1830-1901) Франсуа Мари Рауль , работавший в университете в Гренобле, был первым ученым-экспериментатором, сделавшим достаточно точные измерения, позволившие описать влияние растворенного вещества на физические свойства растворителя.
Слайд 6

5.1 Первый закон Рауля : давление пара над раствором нелетучего вещества меньше давления пара над чистым растворителем.
Слайд 7

Это явление объясняется тем, что нелетучее растворенное вещество связывает часть молекул растворителя в виде сольватов (гидратов), тормозя процесс испарения.
Слайд 8
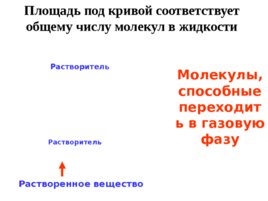
Молекулы, способные переходить в газовую фазу Растворитель Растворитель Растворенное вещество Площадь под кривой соответствует общему числу молекул в жидкости
Слайд 9

Для неэлектролитов Р 0 -Р υ (X) ------ ---------------- Р 0 υ (X) υ (р-ль) Математическое описание первого закона Рауля для бинарной системы
Слайд 10

р о – давление насыщенного пара над чистым растворителем, р – давление пара над раствором нелетучего вещества, υ (X) – химическое количество растворенного вещества
Слайд 11

Р 0 -Р ------ - Р 0 относительное понижения давления пара над раствором
Слайд 12

Для электролитов Р 0 -Р i υ (X) ------ ---------------- Р 0 i υ (X) υ (р-ль)
Слайд 13

i – изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы .
Слайд 14

Криоскопический ("криос"–холод) и эбулиоскопический ("эбулио"-кипение) законы являются следствием первого закона Рауля.
Слайд 15

5.2 Эбулиоскопический закон Рауля: раствор нелетучего вещества кипит при более высокой температуре, чем чистый растворитель . .
Слайд 16

Температура кипения (Т кип ) - это температура, при которой давление пара над жидкостью равно атмосферному давлению.
Слайд 17
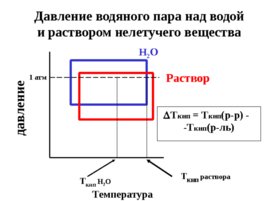
давление Температура H 2 O Раствор T кип H 2 O T кип раствора 1 атм Давление водяного пара над водой и раствором нелетучего вещества Т кип T кип (р-р) - -T кип (р-ль)
Слайд 18

Математическое описание эбулиоскопического закона m (X) 1000 Е ------------------------- М (X) m ( р-ль ) Для неэлектролитов Т кип Е C m Т кип
Слайд 19

m (X) 1000 i Е ------------------------- М (X) m ( р-ль ) Для электролитов Т кип i Е C m Т кип
Слайд 20

Е – эбулиоскопическая константа растворителя Е (Н 2 О) 0,52
Слайд 21

5.3 Криоскопический закон Рауля: раствор нелетучего вещества замерзает при более низкой температуре, чем чистый растворитель.
Слайд 22

Температура замерзания (Т зам ) - это температура, при которой давление пара над жидкостью равно давлению над твердым растворителем.
Слайд 23

Математическое описание криоскопического закона m (X) 1000 К ------------------------- М (X) m ( р-ль ) Для неэлектролитов Т зам К C m Т зам
Слайд 24

m (X) 1000 i К ------------------------- М (X) m ( р-ль ) Для электролитов Т зам i К C m Т зам
Слайд 25

Т зам T зам (р-ль) - T зам (р-р) Для плазмы крови человека Т зам 0,56 0 Для плазмы животных Т зам 0,58 0
Слайд 26

К – криоскопическая константа растворителя К (Н 2 О) 1,86
Слайд 27

Эбуллиоскопия и криоскопия - это методы, позволяющие экспериментально определить молярные массы растворенных веществ, а также некоторые другие характеристики растворов.
Слайд 28

Определение молярной массы лекарственных препаратов криоскопическим методом широко применяется в фармакопейных анализах.
Слайд 29

5.4 Все растворы обладают способностью к диффузии. Диффузия - это равномерное распределение вещества по всему объему раствора, протекающая по всем направлениям. Ее движущая сила - стремление к максимуму энтропии.
Слайд 30

Можно создать условие, при котором диффузия протекает только в одном направлении. Для этого раствор и растворитель разделяют полупроницаемой мембраной , через которую могут проходить только молекулы (ионы) небольшого размера.
Слайд 31

Осмос - односторонняя диффузия растворителя через полупроницаемую мембрану из растворителя в раствор или из разбавленного раствора в более концентрированный.
Слайд 32
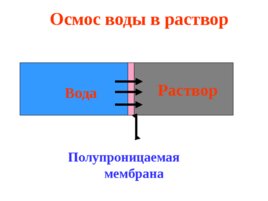
Раствор Вода Полупроницаемая мембрана Осмос воды в раствор
Слайд 33
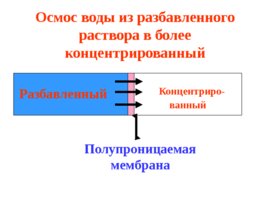
Концентриро- ванный Разбавленный Полупроницаемая мембрана Осмос воды из разбавленного раствора в более концентрированный
Слайд 34

Движущей силой осмоса является стремление к выравниванию концентрации растворенного вещества по обе стороны мембраны.
Слайд 35

Процесс протекает само-произвольно и сопровождается увеличением энтропии. Пределом его протекания является состояние равновесия.
Слайд 36

Давление, которое оказывает растворитель на мембрану, называется осмотическим давлением (р осм ).
Слайд 37

Осмотическое давление описывается уравнением Вант- Гоффа. Для неэлектролитов: р осм С м R T Для электролитов: р осм i С м R T
Слайд 38

Якоб Хендрик Вант-Г офф (1852-1911) Я. Х. Вант-Гофф является одним из основателей физической химии и стереохимии. Он заложил основы теории разбавленных растворов.
Слайд 39

Клеточные мембраны животных и растительных организмов являются проницаемыми для воды и небольших ионов. Проходя через них вода создает осмотическое давление. Давление плазмы 740 - 780 к Па (37 0 C).
Слайд 40

Осмотическое давление плазмы и других биологических жидкостей обусловлено главным образом присутствием электролитов.
Слайд 41

В меньшей степени давление создается коллоидными частицами белков, не про-ходящих через мембрану. Осмотическое давление, создаваемое белками, называется онкотическим . Оно составляет всего 3- 4 к Па.
Слайд 42

Осмотический гомеостаз обусловлен работой почек, легких, кожи. Работа по переносу вещества против градиента концентрации называется осмотической.
Слайд 43

Осмос лежит в основе целого ряда физиологических процессов: усвоение пищи, выделение продуктов жизнедеятельности, активный транспорт воды.
Слайд 44

В медицинской практике используют растворы, изоосмотичные с кровью (физиологические растворы). Например, Na C l (0,9%), глюкоза (4,5%)
Слайд 45

Введение физиологических растворов в кровь, спинномозговую жидкость и другие биологические жидкости человека не вызывает осмотического конфликта.
Слайд 46

При введении гипотонического раствора в кровяное русло (р осм 740 к Па) наблюдается набухание эритроцитов вплоть до разрыва клеточной оболочки ( гемолиз ).
Слайд 47

Начальная стадия гемолиза наблюдается при р осм 360 - 400 к Па , полный гемолиз наблюдается при р осм 260 - 300 к Па.
Слайд 48

Плазмолиз (сморщивание эритроцитов) имеет место при введении в кровяное русло гипертонического раствора (р осм 780 к Па).
Слайд 49

Клетка в растворе (a) изотоническом , ( б ) гипотоническом , (в) гипертоническом (а) ( б ) (в)
Слайд 50

Применение гипертонических растворов в медицине 10 %-ный раствор Na Cl используется для лечения гнойных ран; 25 %-ный раствор Mg SO 4 применяется как гипотензивное средство; различные гипертонические растворы используются для лечения глаукомы
Слайд 51

Важной характеристикой растворов, применяемых для внутривенных инъекций, является их осмолярность и осмоляльность . Они характеризуют содержание частиц, не способных диффундировать через клеточную мембрану.
Слайд 52

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
