Презентация - Химическое равновесие
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 97%
- Слайдов: 60
- Просмотров: 6113
- Скачиваний: 3194
- Размер: 0.08 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Химическое равновесие (04,10,2019)
Химическое равновесие (04,10,2019) Простые механизмы. Рычаг. Условие равновесия рычага
Простые механизмы. Рычаг. Условие равновесия рычага Амфотерность химических соединений
Амфотерность химических соединений Роль воды в химических реакциях
Роль воды в химических реакциях Химические источники тока. Электролиз (химия)
Химические источники тока. Электролиз (химия) Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Променад на химическом балу
Променад на химическом балу
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 3
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Слайд 2

План 3 .1. Кинетическое и термодинамическое описание химического равновесия 3 .2. Смещение химического равновесия (принцип Ле Шателье). 3 .3. Равновесие в биосредах.
Слайд 3

3 .1 Обратимыми называются химические реакции и физико-химические процессы, самопроизвольно протекающие как в прямом, так и в обратном направлении
Слайд 4
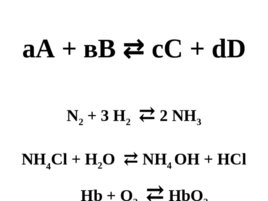
а А в В с С d D N 2 3 H 2 2 NH 3 NH 4 Cl H 2 O NH 4 OH HCl Hb O 2 Hb O 2
Слайд 5

К. Л. Бертолле (1748-1822) Изучая реак-ции выпаде-ния осадков из растворов, Бертолле первым при - шел к выводу об обратимос - ти химических процессов
Слайд 6

Участвуя в Египетском походе французской армии как научный консультант Наполеона, Бертолле обнаружил отложения Na 2 CO 3 на берегу озер с соленой водой, что позволило ему сделать вывод об обратимости изученной ранее химической реакции: Na 2 CO 3 Ca Cl 2 Ca CO 3 2 Na Cl
Слайд 7

Пределом протекания обратимых процессов является состояние химического равновесия
Слайд 8

Химическое равновесие - это такое состояние обратимого процесса, в котором скорость прямой и обратной реакций равны между собой.
Слайд 9
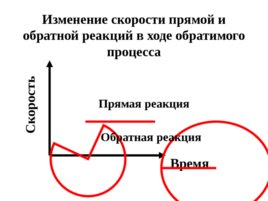
Изменение скорости прямой и обратной реакций в ходе обратимого процесса Время Скорость Прямая реакция Обратная реакция
Слайд 10

Признаком химического равновесия является постоянство во времени концентраций всех веществ, участвующих в процессе.
Слайд 11

Концентрации веществ в состоянии химического равновесия называются равновесными: Ā , моль/л.
Слайд 12
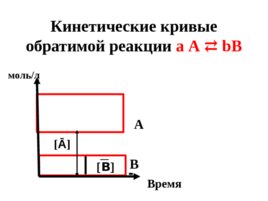
Кинетические кривые обратимой реакции а А b В Ā B A B Время моль / л
Слайд 13

Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ (Гульдберг-Вааге,1884 )
Слайд 14

υ пр k пр A a B b υ обр k обр C c D d k - константа скорости В состоянии равновесия
Слайд 15

υ пр υ обр , следовательно Так как k пр C c D d k обр A a B b
Слайд 16

k пр k обр К c где K с – концентрационная константа равновесия
Слайд 17

C c D d A a B b K c Закон действующих масс для обратимой реакции
Слайд 18
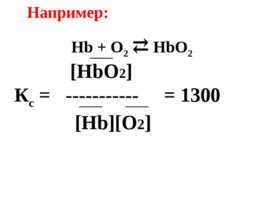
Hb O 2 К с ----------- 1300 Hb O 2 Например: Hb O 2 Hb O 2
Слайд 19

Если в химической реакции участвуют газообразные, жидкие и твердые вещества, то для расчета К с используют только равновесные концентрации газов
Слайд 20
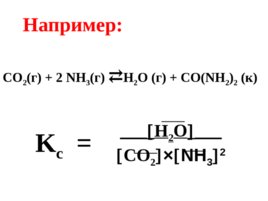
Например: CO 2 ( г ) 2 NH 3 ( г ) H 2 O (г) CO(NH 2 ) 2 (к) H 2 O CO 2 NH 3 2 K c
Слайд 21

Для описания обратимых газофазных реакций используют константу химического равновесия, обозначаемую K p :
Слайд 22
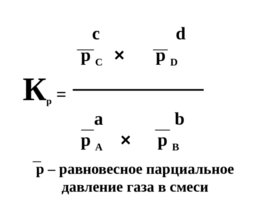
с d р С р D К р а b р А р В p – равновесное парциальное давление газа в смеси
Слайд 23

Соотношение K с и К р описывается уравнением: К с К р (RT) (а b - c - d )
Слайд 24

Если К 1 равновесие смещено вправо, υ пр υ обр ; Если К пр υ обр
Слайд 25

В основе термодинамического описания обратимого процесса лежит уравнение изотермы химической реакции
Слайд 26

В состоянии химического равновесия Δ G 0 , а концентрации веществ А, В, С, D являются равновесными . Соответственно Δ G o - RT ln K - уравнение химического сродства
Слайд 27

- G 0 /RT K e Термодинамический расчет константы равновесия: K зависит только от температуры и природы реагирующих веществ
Слайд 28

3 .2 Состояние химического равновесия является наиболее энергетически выгодным состоянием обратимого процесса, так как характеризуется минимальным запасом внутренней энергии системы ( G min )
Слайд 29
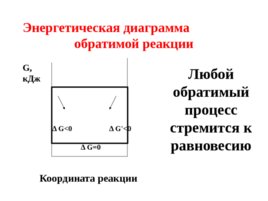
Энергетическая диаграмма
обратимой реакции Δ G 0 Δ G Δ G' G , к Дж Координата реакции Любой обратимый процесс стремится к равновесию
Слайд 30

В 1884 г. французский физико-химик и металлург Ле Шателье сформулировал общий закон смещения химического равовесия Анри Луи Ле Шателье (1850–1936)
Слайд 31

Принцип Ле Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие».
Слайд 32

В любом случае равновесие будет смещаться до тех пор, пока не наступит новое положение равновесия, которое соответствует новым условиям. Этот принцип позволяет предсказать качественные изменения в равновесной системе при изменении условий
Слайд 33

A ) повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры - в сторону экзотермической реакции Частные случаи принципа Ле Шателье
Слайд 34

Hb O 2 Hb O 2 , Δ r Н - 10 к Дж При повышении температуры равновесие смешается влево ( кровь отдает кислород тканям ), при понижении температуры равновесие смещается вправо ( кровь обогащается кислородом ). Смещение равновесия in vivo
Слайд 35

Б) при повышении давления равновесие смещается в сторону меньшего количества газообразных веществ, а при понижении давления - в сторону их большего количества. Частные случаи принципа Ле Шателье
Слайд 36

Изменение давления не влияет на смещение химического равновесия, если: В реакции не участвуют газы; Реакция протекает без изменения количества газообразных веществ N 2 O 2 2 NO
Слайд 37

Венозная кровь поступает в легкие, где испытывает повышенное давлении О 2 . В результате равновесие смещается вправо ( кровь насыщается кислородом ) . Артериальная кровь, поступающая в ткани, оказывается при пониженном давлении кислорода, в результате чего равновесие смещается влево ( кровь отдает кислород тканям ). Смещение равновесия in vivo Hb O 2 Hb O 2
Слайд 38

B ) при увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается в сторону той реакции, которая протекает с убылью этого вещества ( и наоборот ) . Частные случаи принципа Ле Шателье
Слайд 39

Смещение равновесия in vivo Hb O 2 Hb O 2 При увеличении содержания гемоглобина в крови равновесие смещается вправо ( ткани обогащаются кислородом ). При недостатке гемоглобина (анемия) равновесие смещается влево ( больной страдает от кислородной недостаточности ).
Слайд 40

3 .3 Важнейшей биосредой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического равновесия.
Слайд 41

Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов (протолитические равновесия) .
Слайд 42

Диссоциация воды Вода – слабый электролит, диссоциацию которого можно представить схемой: H 2 O H OH -
Слайд 43

При комнатной температуре из 5 млн . молекул воды на ионы диссоциирует только одна
Слайд 44

Поскольку H 2 O H ( OH - ), то можно считать, что H 2 O const
Слайд 45
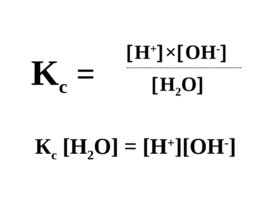
H OH - ---------------------------------------------------- H 2 O K c К с H 2 O H OH -
Слайд 46

K с H 2 O K w K w - ионное произведение воды , константа равновесия, описывающая обратимую диссоциацию воды . К w H OH - 10 -14 (t 25 o C)
Слайд 47

H Kw -------- OH - OH - Kw --------- H Для воды и водных растворов:
Слайд 48

Диссоциация слабых кислот
CH 3 COOH CH 3 COO - H H CH 3 COO - CH 3 COOH K a K a - константа равновесия, называемая константой кислотности
Слайд 49

Диссоциация слабых оснований
NH 4 OH NH 4 OH - NH 4 OH - NH 4 OH K b K b - константа равновесия, называемая константой основности
Слайд 50

Чем больше К а и K b , тем сильнее диссоциируют кислоты и основания в водных растворах
Слайд 51

Гидролиз (гидролитическое разложение) – это реакция разложения сложных веществ на более простые под воздействием воды
Слайд 52

Гидролиз солей
- это реакция ионного обмена между составными частями соли и воды, протекающая с изменением кислотности раствора
Слайд 53

Гидролиз соли, образованной слабым основанием и сильной кислотой NH 4 Cl H 2 O NH 4 OH H Cl NH 4 H 2 O NH 4 OH H
Слайд 54

NH 4 OH H NH 4 К г NH 4 OH Kw NH 4 OH - K w K b К г – константа равновесия, называемая константой гидролиза
Слайд 55

Гидролиз соли, образованной слабой кислотой и сильным основанием CH 3 COO Na H 2 O CH 3 COOH Na OH CH 3 COO - H 2 O СH 3 COOH OH - K w K a К г
Слайд 56

Гидролиз соли, образованной слабым основанием и слабой кислотой CH 3 COO NH 4 H 2 O NH 4 OH CH 3 COOH К г K w K a K b
Слайд 57

Способность соли к гидролизу характеризуется при помощи степени гидролиза (h): h Количество гидролизуемой соли Общее количество соли в растворе
Слайд 58

h К г / C M Чем больше константа гидролиза, тем сильнее гидролизуется соль .
Слайд 59

Гидролиз солей - один из факторов, регулирующих кислотность внутренней среды организма .
Слайд 60

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
