Презентация - Амфотерность химических соединений
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 89%
- Слайдов: 20
- Просмотров: 5202
- Скачиваний: 2103
- Размер: 3.08 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Основные положения теории химического строения органических соединений
Основные положения теории химического строения органических соединений Соединение брусков
Соединение брусков Соединения с подшипниками качения
Соединения с подшипниками качения Соляная гора в Германии - Природные соединения щелочных металлов
Соляная гора в Германии - Природные соединения щелочных металлов Классы неорганических соединений
Классы неорганических соединений Химия 9 класс «Металлы и их соединения»
Химия 9 класс «Металлы и их соединения» Роль воды в химических реакциях
Роль воды в химических реакциях
Слайды и текст этой онлайн презентации
Слайд 1

Амфотерность химических соединений.
учитель химии МОБУ СОШ ЛГО с. Пантелеймоновка
Г. П. Яценко
Неорганическая и органическая химии
Неорганическая и органическая химии
Слайд 2

Амфотерность (переменность) – проявление химическим соединением кислотных или основных свойств в зависимости от условий ( чаще всего
от среды реакции).
Слайд 3
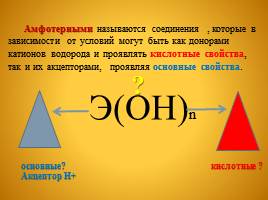
Амфотерными называются соединения , которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, проявляя основные свойства.
Э(OH)n
?
основные? кислотные ? Акцептор Н+
Э(OH)n
?
основные? кислотные ? Акцептор Н+
Слайд 4

Амфотерность в свойствах проявляют оксиды металлов и их гидроксиды.
Обозначения: основные оксиды амфотерные оксиды кислотные оксиды
Неорганическая химия
Обозначения: основные оксиды амфотерные оксиды кислотные оксиды
Неорганическая химия
Слайд 5
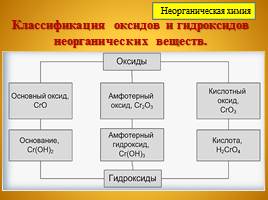
Классификация оксидов и гидроксидов неорганических веществ.
Неорганическая химия
Неорганическая химия
Слайд 6
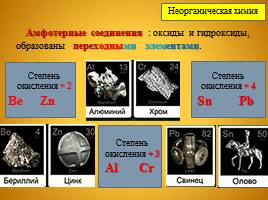
Амфотерные соединения : оксиды и гидроксиды, образованы переходными элементами.
Степень окисления + 2 Be Zn
Степень окисления + 3 Al Cr
Степень окисления + 4 Sn Pb
Неорганическая химия
Степень окисления + 2 Be Zn
Степень окисления + 3 Al Cr
Степень окисления + 4 Sn Pb
Неорганическая химия
Слайд 7
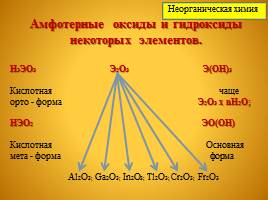
Амфотерные оксиды и гидроксиды некоторых элементов.
H3ЭО3 Э2О3 Э(ОН)3
Кислотная чаще
орто - форма Э2О3 х nH2O;
НЭО2 ЭО(ОН)
Кислотная Основная
мета - форма форма
Al2O3; Ga2O3; In2O3; Tl2O3; Cr2O3; Fr2O3
Неорганическая химия
Неорганическая химия
Слайд 8

Типичным амфотерным соединением является вода, которая незначительно диссоциирует:
H2O ↔ H ‡+ OH.¯
В присутствии кислоты вода – слабый электролит ведет себя как основание ( принимает Н +), а в присутствии основания – как кислота (отдает Н+).
Н2О
среда кислая среда щелочная
+ (Н +) - (Н+) Итог: основание ; кислота
Неорганическая химия
Н2О
среда кислая среда щелочная
+ (Н +) - (Н+) Итог: основание ; кислота
Неорганическая химия
Слайд 9
Неорганическая химия
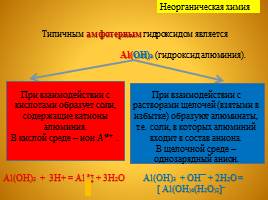
Типичным амфотерным гидроксидом является Al(OH)3 (гидроксид алюминия).
При взаимодействии с кислотами образует соли, содержащие катионы алюминия. В кислой среде – ион Al³‡...
При взаимодействии с растворами щелочей (взятыми в избытке) образуют алюминаты, т.е. соли, в которых алюминий входит в состав аниона. В щелочной среде – однозарядный анион.
Al(OH)3 + 3H+ = Al ³‡ + 3H2O
Al(OH)3 + OH¯ + 2H2O = [ Al(OH)4(H2O)2]¯
Типичным амфотерным гидроксидом является Al(OH)3 (гидроксид алюминия).
При взаимодействии с кислотами образует соли, содержащие катионы алюминия. В кислой среде – ион Al³‡...
При взаимодействии с растворами щелочей (взятыми в избытке) образуют алюминаты, т.е. соли, в которых алюминий входит в состав аниона. В щелочной среде – однозарядный анион.
Al(OH)3 + 3H+ = Al ³‡ + 3H2O
Al(OH)3 + OH¯ + 2H2O = [ Al(OH)4(H2O)2]¯
Слайд 10

Zn
ZnO цинк - переходный
Zn(OH)2 элемент.
Гидроксид – основание Гидроксид – кислота
Zn(OH)2 H2ZnO2
Условия течения реакций влияют на образование конечного продукта: Вещества берутся в твердом виде и спекаются. Образуются твердые соединения – мета- и ортоформы. Вещества берутся в растворах. Образуются комплексные соединения.
Неорганическая химия
Условия течения реакций влияют на образование конечного продукта: Вещества берутся в твердом виде и спекаются. Образуются твердые соединения – мета- и ортоформы. Вещества берутся в растворах. Образуются комплексные соединения.
Неорганическая химия
Слайд 11

Некоторые оксиды и гидроксиды с кислотно-основными свойствами:
элемент оксид Гидроксид-основание Гидроксид-кислота
Ве ВеО Ве(ОН)2 Н2ВеО2
Zn ZnO Zn(OH)2 H2ZnO2
Al Al2O3 Al(OH)2 H3AlO3- алюминивая кислота (ортоформа). HAlO2 – метаалюминиевая кислота (метаформа)
Cr Cr2O3 Cr(OH)3 H3CrO3-хромовая кислота (ортоформа) HCrO2- метахромовая кислота (метаформа)
Pb PbO2 Pb(OH)4 PbO(OH)2 (PbO nH2O) H4PbO4 – (ортоформа) H2PbO3- (метаформа)
Неорганическая химия
элемент оксид Гидроксид-основание Гидроксид-кислота
Ве ВеО Ве(ОН)2 Н2ВеО2
Zn ZnO Zn(OH)2 H2ZnO2
Al Al2O3 Al(OH)2 H3AlO3- алюминивая кислота (ортоформа). HAlO2 – метаалюминиевая кислота (метаформа)
Cr Cr2O3 Cr(OH)3 H3CrO3-хромовая кислота (ортоформа) HCrO2- метахромовая кислота (метаформа)
Pb PbO2 Pb(OH)4 PbO(OH)2 (PbO nH2O) H4PbO4 – (ортоформа) H2PbO3- (метаформа)
Неорганическая химия
Слайд 12

Комплексными называются соединения, в которых хоты бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание».
NH3 + HCl = [ NH4]Cl
хлорид аммония
C6H5NН2 + HCl = [C6H5NH3]Cl
! Назовите вещество.
Неорганическая химия
Неорганическая химия
Слайд 13

Для объяснения строения и свойств комплексных соединений в 1893 г. швейцарец А.Вернер разработал координационную теорию , в основу которой легли представления о пространственном строении веществ и теория электролитической диссоциации.
Альфред Вернер (1866 – 1919)
Неорганическая химия
Альфред Вернер (1866 – 1919)
Неорганическая химия
Слайд 14
Органическая химия
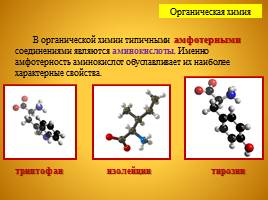
В органической химии типичными амфотерными соединениями являются аминокислоты. Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
триптофан изолейцин тирозин
В органической химии типичными амфотерными соединениями являются аминокислоты. Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
триптофан изолейцин тирозин
Слайд 15

Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
Способности в растворе образовывать в результате диссоциации диполярный ион:
NH2 – CH – COOH [ + NH3 – CH – COO¯]
R R
диполярный ион
Аминокислоты могут вступать друг с другом в реакции поликонденсации, образуя полипептиды и белки (важные клеточные процессы).
Органическая химия
Органическая химия
Слайд 16

Практическая часть.
Эксперимент № 1.
Оборудование : штатив с пробирками.
Получить гидроксид алюминия, имея AlCl3 ; NH3 H2O.
AlCl3 + 3NH4OH = Al(OH)3 + 3NH4Cl гидроксид алюминия
Составить итоговое сокращенное ионное уравнение. Зафиксировать в отчетный листок наблюдения.
Получить гидроксид алюминия, имея AlCl3 ; NH3 H2O.
AlCl3 + 3NH4OH = Al(OH)3 + 3NH4Cl гидроксид алюминия
Составить итоговое сокращенное ионное уравнение. Зафиксировать в отчетный листок наблюдения.
Слайд 17

Эксперимент № 2.
Оборудование: штатив с пробирками.
Реактивы: гидроксид алюминия; едкий натр (раствор).
Доказать кислотные свойства, полученного гидроксида алюминия (эксперимент № 1).
Al(OH)3 + NaOH = Na[Al(OH)4] кислота раствор тетра-гидроксо-алюминат натрия
Зафиксировать наблюдения. Составить характеристику комплексному соединению: строение внутренней сферы --- комплексообразователь --- лиганды --- координационное число комплексообразователя ---
Доказать кислотные свойства, полученного гидроксида алюминия (эксперимент № 1).
Al(OH)3 + NaOH = Na[Al(OH)4] кислота раствор тетра-гидроксо-алюминат натрия
Зафиксировать наблюдения. Составить характеристику комплексному соединению: строение внутренней сферы --- комплексообразователь --- лиганды --- координационное число комплексообразователя ---
Слайд 18

Эксперимент № 3.
Оборудование : штатив с пробирками.
Реактивы : гидроксид алюминия; соляная кислота (раствор).
Доказать основные свойства, полученного гидроксида алюминия (эксперимент № 1).
Al(OH)3 + 3HCl = AlCl3 + 3H2O основание хлорид алюминия
Составить итоговое сокращенное ионное уравнение. Зафиксировать в отчетный листок наблюдения.
Доказать основные свойства, полученного гидроксида алюминия (эксперимент № 1).
Al(OH)3 + 3HCl = AlCl3 + 3H2O основание хлорид алюминия
Составить итоговое сокращенное ионное уравнение. Зафиксировать в отчетный листок наблюдения.
Слайд 19

Вывод по экспериментальной работе:
Экспериментально убедились в проявлении амфотерности – кислотно – основных свойств гидроксида алюминия.
Экспериментально убедились в проявлении амфотерности – кислотно – основных свойств гидроксида алюминия.
Слайд 20

http://flogia.ru/wp-content/uploads/2011/11/farm-himija.jpg
http://adgi.ru/wp-content/uploads/2014/10/kollazh.jpg
http://chemege.ru/wp-content/uploads/2014/09/12.jpg
http://www.znanijamira.ru/img/87/23.jpg
https://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt(III).png/132px-Cis-dichlorotetraamminecobalt(III).png
http://www.nazdor.ru/upload/iblock/f16/ac2a87520989ea5a816538a14f8e882a.jpg
http://fashionstylist.kupivip.ru/sites/fashion-kupivip/files/styles/step_full/public/main-10794-7eeb81ba87dd10910e5a06a832d91bfe.jpg
http://elementy.ru/images/news/tyrosine_300.jpg
Материал, используемый при оформлении
Материал, используемый при оформлении
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
