Презентация - Кислотно-основное равновесие в растворах
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 87%
- Слайдов: 58
- Просмотров: 5422
- Скачиваний: 2632
- Размер: 0.09 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Иллюстративная презентация по трем основным линиям романа «Мастер и Маргарита» 1928-1940 гг.
Иллюстративная презентация по трем основным линиям романа «Мастер и Маргарита» 1928-1940 гг. Урок-путешествие «Кислоты»
Урок-путешествие «Кислоты» Юрта-основное жилище кочевых Татар и Башкир
Юрта-основное жилище кочевых Татар и Башкир Простые механизмы. Рычаг. Условие равновесия рычага
Простые механизмы. Рычаг. Условие равновесия рычага Машины для основной обработки почвы. Лущильники
Машины для основной обработки почвы. Лущильники Государство. Основной институт политической системы общества
Государство. Основной институт политической системы общества Основные устройства персонального компьютера
Основные устройства персонального компьютера
Слайды и текст этой онлайн презентации
Слайд 1

Лекция 7 Кислотно-основное равновесие в растворах
Слайд 2

7.1. Кислотность водных растворов и биологических жидкостей. 7.2 Буферные растворы. 7.3 Буферные системы крови. План
Слайд 3

7.1 Кислотность является важной характеристикой как водных растворов, так и биологических жидкостей. Она определяется соотношением концентраций ионов Н и ОН - .
Слайд 4

Для характеристики кислотности используется водородный показатель (р Н) : р Н - lg H - для слабых электролитов р Н - lg а Н - для сильных электролитов
Слайд 5

Реже для характеристики реакции среды используется гидроксильный показатель ( р ОН ) : р ОН - lg OH - – для слабых электролитов р ОН - lg а OH - – для сильных электролитов
Слайд 6

Для одного раствора р Н р ОН 14
Слайд 7

Используя уравнение К W H OH - 10 -14 , рассчитаем концентрации ионов в нейтральном растворе H OH - 10 -14 10 -7 моль/л Соответственно р Н -lg 10 -7 7 р O Н -lg 10 -7 7
Слайд 8

В кислой среде: H OH - р Н 7, р ОН 7 В щелочной среде: H OH - p H 7, p OH 7
Слайд 9
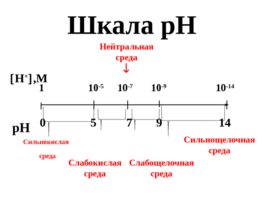
Шкала р Н Н ,M p H 1 10 -5 10 -7 10 -9 10 -14 0 5 7 9 14 Сильнокислая среда Сильнощелочная среда Слабокислая среда Слабощелочная среда Нейтральная среда
Слайд 10
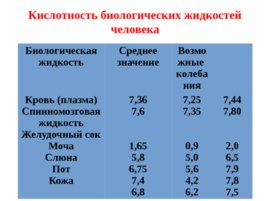
Биологическая жидкость Среднее значение Возможные колебания Кровь (плазма) Спинномозговая жидкость Желудочный сок Моча Слюна Пот Кожа 7,36 7,6 1,65 5,8 6,75 7,4 6,8 7,25 7,35 0,9 5,0 5,6 4,2 6,2 7,44 7,80 2,0 6,5 7,9 7,8 7,5 Кислотность биологических жидкостей человека
Слайд 11

Для биологических жидкостей характерен кислотно-основной гомеостаз (постоянство значений р Н), обусловленный действием биологических буферных систем.
Слайд 12

Наиболее опасными видами нарушения кислотно-основного равновесия в крови являются: ацидоз – увеличение кислотности крови, алкалоз –увеличение щелочности крови.
Слайд 13
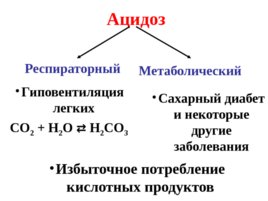
Ацидоз Респираторный Метаболический Гиповентиляция легких CO 2 H 2 O H 2 CO 3 Сахарный диабет и некоторые другие заболевания Избыточное потребление кислотных продуктов
Слайд 14
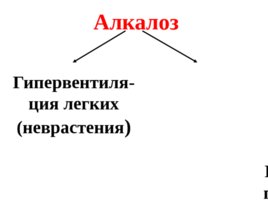
Алкалоз Гипервентиля - ция легких (неврастения ) Избыточное потребление щелочных продуктов
Слайд 15

Опасность изменения р Н связана 1) со снижением активности ферментов и гормонов, активных в узком диапазоне р Н;
Слайд 16

2) с изменением осмотического давления биологических жидкостей; 3) с изменением скорости биохимических реакций, катализируемых катионами Н .
Слайд 17

При изменении р Н крови на 0,3 единицы может наступить тяжелое коматозное состояние, а 0,4 единицы - смертельный исход.
Слайд 18

Коррекция ацидоза - внутривенное введение 4%-ного раствора Na HCO 3 : HCO 3 - H H 2 CO 3 Антацидными (гипоцидными) называются лекарственные препараты, снижающие кислотность биологических жидкостей
Слайд 19

Коррекция алкалоза- внутривенное введение растворов аскорбиновой кислоты (5% или 15%).
Слайд 20

Повышение кислотности в ротовой полости связано с приемом пищи (особенно сладкой). При этом происходит разрушение зубной эмали (толщина которой всего 2 мм): Сa 5 (PO 4 ) 3 F (к) 5 Са 2 3 РО 4 3- F - В норме равновесие смещено влево. При избыточной кислотности концентрация F - уменьшается: Н F - Н F. Равновесие смещается вправо .
Слайд 21

Методы определения кислотности растворов 1. Кислотно-основное титрование. 2. Кислотно-основные индикаторы.
Слайд 22

3. Потенциометрический метод
Слайд 23

7 .2 Буферными называют растворы, р Н которых не изменяется при добавлении небольших количеств кислот или щелочей, а также при разбавлении их водой.
Слайд 24

Протолитическая теория кислот и оснований Бренстеда-Лоури (1923) объясняет механизм буферного действия. Согласно этой теории, кислота – это донор протонов.
Слайд 25

Различают: кислоты–молекулы (CH 3 COOH) , кислоты-катионы (NH 4 ) , кислоты–анионы (H 2 PO 4 - )
Слайд 26

Каждая кислота сопряжена со своим основанием. Основание – это акцептор протонов.
Слайд 27

C опряженные пары кислот и оснований С H 3 COOH CH 3 COO - H Кислота Сопряженное основание
Слайд 28

C опряженные пары кислот и оснований NH 4 NH 3 H Кислота Сопряженное основание
Слайд 29

C опряженные пары кислот и оснований H 2 PO 4 - HPO 4 2- H Кислота Сопряженное основание
Слайд 30

Буферный раствор содержит кислоту и сопряженное с ней основание. Именно поэтому он способен нейтрализовывать как добавленную кислоту, так и добавленное основание.
Слайд 31

Классификация буферных растворов Ацетатный буфер: СН 3 СООН/СН 3 СООNa Механизм буферного действия НCl CH 3 COONa CH 3 COOH Na Cl Нейтрализация добавленной кислоты Na OH CH 3 COOH CH 3 COONa H 2 O Нейтрализация добавленной щелочи 1)Слабая кислота/ ее соль
Слайд 32

2) Слабое основание/его соль Аммиачный буфер: N Н 3 / N Н 4 С l Механизм буферного действия НCl N H 3 NH 4 C l Нейтрализация добавленной кислоты Na OH NH 4 C l N H 3 Na Cl H 2 O Нейтрализация добавленной щелочи
Слайд 33

3) Две кислые соли Гидрофосфатный буфер : N а Н 2 PO 4 / N а 2 Н PO 4 Механизм буферного действия НCl Na 2 H PO 4 Na H 2 PO 4 Na C l Нейтрализация добавленной кислоты Na OH N а H 2 PO 4 Na 2 H PO 4 H 2 O Нейтрализация добавленной щелочи
Слайд 34

4) кислая соль/средняя соль Карбонатный буфер : N а НС O 3 / N а 2 С O 3 Механизм буферного действия НCl Na 2 С O 3 Na H С O 3 Na C l Нейтрализация добавленной кислоты Na OH N а H С O 3 Na 2 С O 3 H 2 O Нейтрализация добавленной щелочи
Слайд 35

Уравнение Гендерсона- Гассельбаха позволяет рассчитать р Н буферного раствора: р Н р К а - lg кислота сопряженное основание р К а - lg K a
Слайд 36

Буферная емкость раствора (В, ммоль/л) - это количества сильных кислот или щелочей, при прибавлении которых к 1 л буферного раствора, происходит изменение р Н на единицу.
Слайд 37

С н V В ----------------- , р Н - р Н о V бр где С н - нормальность добавляемых кислот или щелочей, моль/л V – их объем, мл V бр - объем буферного раствора, л
Слайд 38

Буферная емкость зависит: от концентрации: чем концентрированнее раствор, тем больше его буферная емкость; 2) от соотношения концентраций компонентов комп. 1 В max при ----------- 1 комп. 2
Слайд 39

Чем больше буферная емкость раствора, тем эффективнее он поддерживает кислотно - основное равновесие.
Слайд 40

Характеристиками биологических буферных систем являются: B к – буферная емкость по кислоте, B щ – буферная емкость по щелочи. Как правило, B к B щ
Слайд 41

В организме человека в спокойном состоянии ежесуточно образуется количество кислоты, эквивалентное 2,5 л HCl (конц).
Слайд 42

7.3 Из буферных систем организма наибольшей емкостью характеризуются буферные системы крови, которые распределены между эритроцитами и плазмой.
Слайд 43
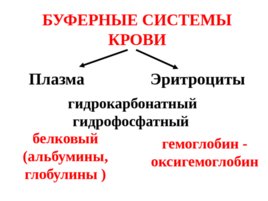
БУФЕРНЫЕ СИСТЕМЫ КРОВИ Плазма Эритроциты гидрокарбонатный гидрофосфатный белковый (альбумины, глобулины ) гемоглобин - оксигемоглобин
Слайд 44

Гидрокарбонатный (водокарбонатный) буфер: H 2 CO 3 /HCO 3 - ферм. СО 2 Н 2 О Н 2 СО 3 НСО 3 - Н Механизм буферного действия: Н НСО 3 - Н 2 СО 3 ОН - Н 2 СО 3 НСО 3 - Н 2 О
Слайд 45

В крови HCO 3 - 40 H 2 CO 3 1 избыток гидрокарбоната создает щелочной резерв крови В к 40 ммоль/л; В щ 1-2 ммоль/л.
Слайд 46

Гидрокарбонатный буфер связан со всеми буферными системами вне- и внутри-клеточных жидкостей. Всякие изменения в них сказываются на концентрации составляющих данного буфера.
Слайд 47

Анализируя содержание НСО 3 - в крови можно диагностировать наличие дыхательных и метаболических нарушений.
Слайд 48

2. Гидрофосфатная буферная система Н 2 PO 4 - /HPO 4 2- В к 1-2 ммоль/л; В щ 0,5 ммоль/л Низкая буферная емкость объясняется низкой концентрацией ионов в крови.
Слайд 49

Однако эта система играет решающую роль в других биологических жидкостях: в моче, соках пищеварительных желез, а также во внутриклеточных жидкостях.
Слайд 50

3. Гемоглобин - оксигемоглобин: ННb/Н b - НН b - слабая кислота ( К а 6,37 10 -9 ) Н Н b - НН b ОН - ННb Hb - H 2 O
Слайд 51
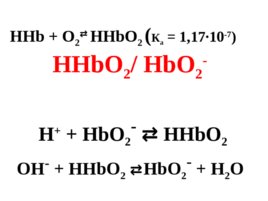
HHb O 2 HHb O 2 ( К а 1,17 10 -7 ) HHb O 2 / Hb O 2 - H Hb O 2 - HHb O 2 OH - HHb O 2 Hb O 2 - H 2 O
Слайд 52

Буферная система гемоглобин-оксигемоглобин обеспечивает 75% буферной емкости крови.
Слайд 53

4. Белковая буферная система (альбумины, глобулины). Белки являются амфотерными полиэлектролитами, существующими в виде биполярных ионов: COOH COO - R - CH R - CH NH 2 NH 3
Слайд 54
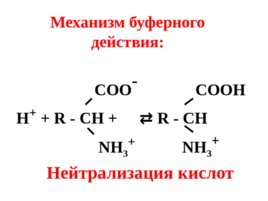
COO - COOH Н R - CH R - CH NH 3 NH 3 Механизм буферного действия: Нейтрализация кислот
Слайд 55
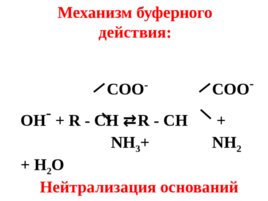
COO - COO - OH - R - CH R - CH NH 3 NH 2 H 2 O Нейтрализация оснований Механизм буферного действия:
Слайд 56

В к (альбуминов) 10 ммоль/л В к (глобулинов) 3 ммоль/л Белковые буферы содержатся не только в крови, но практически во всех биологических жидкостях.
Слайд 57

Буферные системы организма обеспечивают кислотно-основной гомеостаз человека.
Слайд 58

Благодарим за внимание!!!
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
