Слайды и текст этой онлайн презентации
Слайд 2
Водород — первый элемент периодической системы элементов; обозначается символом H.
Слайд 3
Генри Кавендиш
Первым убедился,что при действии кислот на некоторые металлы образуется«ГОРЮЧИЙ ГАЗ», который в смеси с воздухом при поджигании взрывается
1731 - 1810
Слайд 4
Антуан Лавуазье
Первым установил, что водород при сгорании образует воду, и назвал его Hydrogenium – «рождающий воду»
2H2 + О2 –> 2Н2О
1743 - 1794
Слайд 5
Распространение в природе
В земной коре – массовая доля всего – 1% (из-за малой массы атомов водорода);
Входит в состав воды, кислот, нефти, природного газа, большинства органических и многих неорганических веществ;
Во Вселенной – водород самый распространенный элемент: в виде плазмы он составляет 50-80% массы Солнца.
Слайд 6
Строение атома водорода
Атом водорода состоит из ядра и одного электрона.
Электронная конфигурация атома:
1s 1
Слайд 7
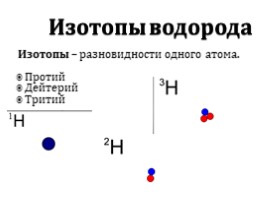
Изотопы водорода
Изотопы – разновидности одного атома.
Протий
Дейтерий
Тритий
Слайд 8
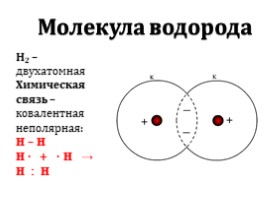
Молекула водорода
Н2 – двухатомная
Химическая связь – ковалентная неполярная:
H – H
H · + · H → H : H
Слайд 9
Физические свойства
Бесцветный газ
Без запаха
Почти нерастворим в воде ( 1: 50 )
Плотность – 0,0899 кг/м3
В 14,5 раз легче воздуха
При -252,8 0С водород сжижается
Слайд 10
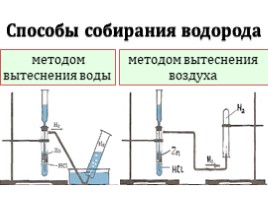
Способы собирания водорода
методом вытеснения воды
методом вытеснения воздуха
Слайд 11
Химические свойства
обладает окислительно-восстановительной амфотерностью
восстановительные св-ва:
А . С НЕМЕТАЛЛАМИ
2Н2 + Сl2 = 2НCl
2Н2 + О2 = 2Н2О
Н2 + S = Н2S
Б. C ОКСИДАМИ МЕТАЛЛОВ
Н2 + СИО = СИ + Н2О
Слайд 12
Применение
Промышленный синтез
Восстановление редких металлов
Вольфрам
Молибден
Слайд 13
Использование
Инженеры и автопроизводители исследуют возможность применения водорода в качестве массового топлива для автомобилей. Одной из перспектив является помещение в топливный бак водорода в твердом состоянии. На этом пути много трудностей, но и преимущества очевидны: если результат будет достигнут, заправляться придется реже.
Водород широко применяется в нефтяной и химической отраслях, а также часто используется для различных физических и инженерных задач: например, в сварочном деле и в качестве охлаждающего вещества.
 Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Химические свойства металлов - Электрохимический ряд напряжения металлов
Химические свойства металлов - Электрохимический ряд напряжения металлов Общие химические свойства металлов
Общие химические свойства металлов Химические свойства кислот
Химические свойства кислот Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Водород - нахождение в природе - Получение и физические свойства водорода
Водород - нахождение в природе - Получение и физические свойства водорода Текстильные материалы из химических волокон - Свойства химических волокон
Текстильные материалы из химических волокон - Свойства химических волокон