Слайды и текст этой онлайн презентации
Слайд 1
Тема урока: « Основания, их классификация и свойства».
Слайд 2
ЦЕЛЬ: - рассмотреть и научиться применять свойства растворимых и нерастворимых оснований
ЗАДАЧИ:
расширить знания об основаниях, как о классе неорганических соединений;
- закрепить умения составлять ионные уравнения
Слайд 3
Ответьте на следующие вопросы: 1. Что такое основание? 2. Что образуется при диссоциации оснований? 3. Назовите ионы, которые образуются при диссоциации гидроксида натрия, гидроксида бария, гидроксида лития. 4. Какие типы реакций вы знаете? Что собой представляет каждый вид?
Слайд 4
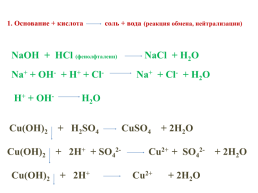
1. Основание + кислота соль + вода (реакция обмена, нейтрализации)
NaOH + HCl (фенолфталеин) NaCl + H2O
Na+ + OH- + H+ + Cl- Na+ + Cl- + H2O
H+ + OH- H2O
Cu(OH)2 + H2SO4 CuSO4 + 2H2O
Cu(OH)2 + 2H+ + SO42- Cu2+ + SO42- + 2H2O
Cu(OH)2 + 2H+ Cu2+ + 2H2O
Слайд 5
2)Основание + оксид неметалла соль + вода ( реакция обмена)
УСЛОВИЕ:
оксиду неметалла должна соответствовать определенная кислота
например: N2+5O5 H N+5O3
S+6O3 H2 S+6O4
2KOH + N2O5 2KNO3 + H2O
2K+ + 2OH- + N2O5 2K+ + 2NO3- + H2O
N2O5 + 2OH- 2NO3- + H2O
2LiOH + SO3 Li2SO4 + H2O
2Li+ + 2OH- + SO3 2Li+ + SO42- + H2O
SO3 + 2OH- SO42- + H2O
Слайд 6
3. Щелочь + соль новое основание + новая соль ( реакция обмена)
УСЛОВИЯ:
образуется осадок;
выделяется газ.
2KOH + CuCl2 Cu(OH)2 + 2KCl
2K+ + 2OH- + Cu2+ + 2Cl- Cu(OH)2 + 2K+ + 2Cl-
Cu2+ + 2OH- Cu(OH)2
Слайд 7
4) Нерастворимое основание оксид металла + вода
(разложение при нагревании)
Mg(OH)2 MgO + H2O
2Fe(OH)3 Fe2O3 + 3H2O
Слайд 8
Закрепление материала:
§ 39, № 3 (б,е,ж)
Домашнее задание:
§ 39, № 3 (а,в,д)
 Тема урока «Форма, строение, состав и свойства костей, рост костей. Типы соединения костей»
Тема урока «Форма, строение, состав и свойства костей, рост костей. Типы соединения костей» Тема урока: классификация животных. Основные систематические группы животных
Тема урока: классификация животных. Основные систематические группы животных Для урока по истории древнего мира. 5 Класс тема: «древнейший рим»
Для урока по истории древнего мира. 5 Класс тема: «древнейший рим» Методика личностно-ориентированного образования на уроках математики
Методика личностно-ориентированного образования на уроках математики Тема урока: особенности природы Африки 7
Тема урока: особенности природы Африки 7 Тема урока по истории: "Древняя Индия". 5 Класс
Тема урока по истории: "Древняя Индия". 5 Класс Доклад учителя «Здоровьесбережение как ресурс повышения эффективности урока математики по ФГОС»
Доклад учителя «Здоровьесбережение как ресурс повышения эффективности урока математики по ФГОС»