Слайды и текст этой онлайн презентации
Слайд 1
Тема урока. Уравнение состояния идеального газа. Решение задач
«Посев научный взойдет для жатвы народной!»
(Дмитрий Иванович Менделеев)
25.01.2021
Слайд 2
Вопросы:
1. Как называется модель на которой рассматривают состояние газообразных тел
(идеальный газ)
2. Какими параметрами характеризуется состояние идеального газа
(давление, объём, температура
3. Как называются эти параметры
(макроскопические)
4. Как термодинамический параметр давление связан с микроскопическими параметрами?
(основное уравнение МКТ)
5. Как объём связан с микроскопическими параметрами?
(объём обратно пропорционален концентрации)
Слайд 3
ОБЪЕДИНИМ ПАРАМЕТРЫ p, V, T
Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа . Выведем уравнение, устанавливающее зависимость между этими параметрами.
Слайд 4
ВСПОМНИМ ФОРМУЛЫ
р = nkT
m = ρV
NA = 6·10²³моль - число Авогадро
– 1
– 23
k = 1,38·10 Дж/К - постоянная Больцмана
Слайд 5
Клапейрон Бенуа Поль Эмиль (1799–1864)
Французский физик и инженер. Родился 26 января 1799 в Париже.
Окончил Политехническую школу (1818). Работал в Институте инженеров путей сообщения в Петербурге (1820–1830). По возвращении во Францию стал профессором Школы мостов и дорог в Париже.
Слайд 6
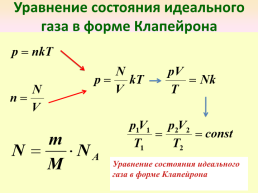
Уравнение состояния идеального газа в форме Клапейрона
Уравнение состояния идеального газа в форме Клапейрона
Слайд 7
Менделеев Дмитрий Иванович (8.02.1834–2.02.1907)
Русский ученый-энциклопедист..
В 1874 вывел общее уравнение состояния идеального газа, обобщив уравнение Клапейрона.
Слайд 8
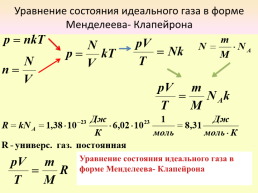
Уравнение состояния идеального газа в форме
Менделеева- Клапейрона
Уравнение состояния идеального газа в форме Менделеева- Клапейрона
Слайд 9
Уравнение Менделеева – Клайперона
Слайд 10
Практическое применение уравнения состояния:
В термометрах…
Уравнение позволяет определить одну из величин, характеризующих состояние, если известны две другие величины. Это используют в термометрах
Слайд 11
Решение задач.
НОРМАЛЬНЫЕ УСЛОВИЯ
1. Давление равно атмосферному
р=1атм= 1,013·10⁵ Па ≈10⁵ Па
2. Температура равна 0ºС
Т = 273К
Задача 1: Найти объём 1моля газа при нормальных условиях
Дано:
ν = 1моль
р = 100000Па
Т = 273К.Решение:
pV = νRT,
V - ?
.
Слайд 12
ЗАДАЧА 2. При температуре 10ºС и давлении 100 кПа воздух занимает объём 5л. Каким будет объём данной массы воздуха при давлении 80кПа и температуре 60ºС?
Дано:
t₁= 10ºC
p₁= 100кПа
V₁= 5л
t₂= 60ºC
p₂= 80кПа.СИ
283 К
10⁵ Па
0,005 м³
333°С
8·10⁴.Решение
V₂- ?
Слайд 13
Домашнее задание: §63 прочитать, ответить на вопросы,
 Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы Основные положения МКТ идеального газа
Основные положения МКТ идеального газа К уроку Уравнение состояния. Газовые законы
К уроку Уравнение состояния. Газовые законы Сельская школа: состояние, проблемы, перспективы развития
Сельская школа: состояние, проблемы, перспективы развития Учимся решать уравнения
Учимся решать уравнения Решение неполного уравнения третьей степени
Решение неполного уравнения третьей степени Проект на тему:. «Влияние цвета на состояние человека»
Проект на тему:. «Влияние цвета на состояние человека»