Слайды и текст этой онлайн презентации
Слайд 1
Основные положения МКТ идеального газа
Составитель: преподаватель физики
Попова М.Н.
Слайд 2
Молекулярная физика
это наука, которая изучает макроскопические элементы состоящие из огромного количества частиц.
Объект изучения: молекула.
Предмет изучения:
тепловые явления,
явление перенос (импульса, вещ-ва, энергии),
изменение агрегатного состояния вещества.
Задачи молекулярной физики –объяснить физические свойства вещества в газообразном, жидком и твердом состояниях, явления перехода из одного состояния в другое, а также процессы, происходящие в веществе при различных внешних воздействиях.
Слайд 3
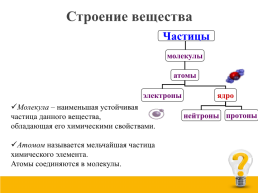
Строение вещества
Молекула – наименьшая устойчивая частица данного вещества,
обладающая его химическими свойствами.
Атомом называется мельчайшая частица химического элемента.
Атомы соединяются в молекулы.
Слайд 4
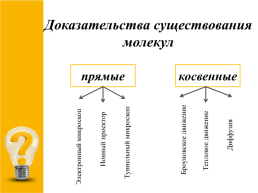
Доказательства существования
молекул
прямые
косвенные
Диффузия
Ионный проектор
Броуновское движение
Тепловое движение
Туннельный микроскоп
Электронный микроскоп
Слайд 5
Прямые доказательства
Туннельный микроскоп
Ионный проектор
Электронный микроскоп
Слайд 6
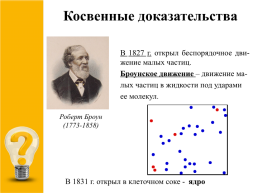
Косвенные доказательства
В 1827 г. открыл беспорядочное дви-жение малых частиц.
Броунское движение – движение ма-
лых частиц в жидкости под ударами
ее молекул.
Роберт Броун
(1773-1858)
В 1831 г. открыл в клеточном соке - ядро
Слайд 7
Косвенные доказательства
Тепловое движение – это беспорядочное хаотическое
движение частиц, из которых состоит вещество.
Слайд 8
Косвенные доказательства
Диффузия – явление взаимного проникновения молекул соприкасающихся веществ в межмолекулярные промежутки
друг друга.
Скорость диффузии наибольшая в газах, а самая маленькая в твердых телах.
Скорость диффузии увеличивается при повышении
температуры.
Диффузия газов обеспечивает однородность атмосферы
вблизи поверхности Земли.
Диффузия способствует нормальному питанию растений,
животных.
Слайд 9
Примеры диффузии в жидких, твердых и газообразных состояниях вещества
Сплав свинца и золота
Чай с молоком
Распыление духов
Слайд 10
Молекулярно-кинетическая теория (МКТ)
теория, объясняющая строение и свойства тел движением и взаимодействием частиц, из которых состоят тела.
Основные положения МКТ
все тела состоят из частиц, разделенных промежутками;
частицы вещества находятся в непрерывном хаотическом движении;
частицы взаимодействуют между собой.
Слайд 11
Свойства газов
1.Давление газа – это сила, с которой газ давит на единицу площади поверхности контактирующих с газом, причем по нормали к этой поверхности.
2.Температура– это система нагретости тела, которая определяет направление теплообмена.
T [К]
Т= t + 273 C
Слайд 12
Свойства газов
3. Объем – это часть пространства занятое газом.
[м3]
4. Плотность – физическая величина, определяемая как отношение массы тела к занимаемому этим телом объёму.
5. Количество вещества – физическая величина, характеризующая количество молекул, входящих в некую порцию вещества.
В одном моле содержится NA=6,022 ∙1023[моль].
Слайд 13
Свойства газов
6. Молярная масса – характеристика вещества, отношение массы вещества к его количеству.
[кг/моль]
Например: М(Н2О)=2∙1+16=18 г/моль=18∙10-3 кг/моль
7. Число молекул
8. Концентрация молекул – количество молекул в единице объема.
 Уравнение состояния идеального газа. Газовые законы
Уравнение состояния идеального газа. Газовые законы Основные положения теории линейной перспективы
Основные положения теории линейной перспективы Формирование основных положений физической картины мира при изучении специальной теории относительности
Формирование основных положений физической картины мира при изучении специальной теории относительности Основные положения клеточной теории
Основные положения клеточной теории Основные положения по эвакуации населения в мирное и военное время - Состав эвакуационных органов и их основные задачи
Основные положения по эвакуации населения в мирное и военное время - Состав эвакуационных органов и их основные задачи Положение основных слоев общества
Положение основных слоев общества Уравнение состояния идеального газа
Уравнение состояния идеального газа