Презентация - Кипение
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 95%
- Слайдов: 42
- Просмотров: 662
- Скачиваний: 47
- Размер: 3.3 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Испарение. Конденсация. Кипение
Испарение. Конденсация. Кипение
 Твердое состояние вещества. Плавление. Кристаллическое и аморфное состояние вещества. Типы связи в кристаллах
Твердое состояние вещества. Плавление. Кристаллическое и аморфное состояние вещества. Типы связи в кристаллах
 Цель работы. Сохранение и укрепление физического здоровья учащихся. Предупреждение и своевременная коррекция распространённых среди школьников.
Цель работы. Сохранение и укрепление физического здоровья учащихся. Предупреждение и своевременная коррекция распространённых среди школьников.
 Человек долга и чести. Юрлов Геннадий Алексеевич. 20 Мая 2022 г. – 95 Лет со дня рождения
Человек долга и чести. Юрлов Геннадий Алексеевич. 20 Мая 2022 г. – 95 Лет со дня рождения
 Урок окружающего мира во 2 классе УМК «школа России»
Урок окружающего мира во 2 классе УМК «школа России»
 Собака друг человека
Собака друг человека
 Проведение независимой оценки качества дооп муниципальный уровень
Проведение независимой оценки качества дооп муниципальный уровень
Слайды и текст этой онлайн презентации
Слайд 1

Слайд 2

Кипение.
Испарение = парообразование происходит со свободной поверхности жидкости при любой положительной температуре.
При определенных условиях – может происходить внутри жидкости
начинается кипение
Разница лишь в количестве молекул, которое испаряется со свободной поверхности жидкости
Испарение = парообразование происходит со свободной поверхности жидкости при любой положительной температуре.
При определенных условиях – может происходить внутри жидкости
начинается кипение
Разница лишь в количестве молекул, которое испаряется со свободной поверхности жидкости
Слайд 3

Кипение.
Кипение – это парообразование во всем объеме жидкости, происходящее, при определенной температуре.
Кипение – это парообразование во всем объеме жидкости, происходящее, при определенной температуре.
Слайд 4

Кипение.
Слайд 5

Кипение.
Кипение происходит при температуре, которая называется температурой кипения. Для каждого вещества она своя. Берется из таблиц.
Процесс:
1. В жидкости всегда есть небольшое количество воздуха в виде пузырьков, невидимых невооруженным глазом. 2. При незначительном нагревании жидкости растет температура пара в пузырьках, возрастает его давление, увеличивается объем пузырька. 3. Под действием силы Архимеда пузырьки начинают подниматься вверх. 4. Попадая в верхние, более холодные слои воды, пузырьки охлаждаются, уменьшаются в объеме и с шумом схлопываются не достигнув поверхности. 5. Последующее увеличение температуры приводит к тому, что внутрь пузырьков с их поверхности испаряются молекулы жидкости. В объеме пузырька получается смесь воздуха и насыщенного пара. 6. При увеличении температуры, давление насыщенного пара растет быстрее, чем давление воздуха => можно считать давление внутри пузырька = давлению насыщенного пара.
Кипение происходит при температуре, которая называется температурой кипения. Для каждого вещества она своя. Берется из таблиц.
Процесс:
1. В жидкости всегда есть небольшое количество воздуха в виде пузырьков, невидимых невооруженным глазом. 2. При незначительном нагревании жидкости растет температура пара в пузырьках, возрастает его давление, увеличивается объем пузырька. 3. Под действием силы Архимеда пузырьки начинают подниматься вверх. 4. Попадая в верхние, более холодные слои воды, пузырьки охлаждаются, уменьшаются в объеме и с шумом схлопываются не достигнув поверхности. 5. Последующее увеличение температуры приводит к тому, что внутрь пузырьков с их поверхности испаряются молекулы жидкости. В объеме пузырька получается смесь воздуха и насыщенного пара. 6. При увеличении температуры, давление насыщенного пара растет быстрее, чем давление воздуха => можно считать давление внутри пузырька = давлению насыщенного пара.
Слайд 6

Кипение.
Процесс:
7. Увеличение объема пузырька: когда давление насыщенного пара внутри превосходит внешнее давление
8. Если глубина сосуда 1 м, то ρ ∙ g ∙ h < pa. Значит им можно пренебречь. 9. При увеличении температуры жидкости объем пузырька возрастает. Когда сила Архимеда становится больше силы тяжести и силы сцепления пузырька со стенкой, то пузырек всплывает. 10. Если пузырьки поднимаются в жидкости, имеющей постоянную температуру, то они увеличиваются в объеме в соответствии с законом Бойля-Мариотта, так как давление в верхних слоях жидкости уменьшается. 11. Всплывая, пузырьки переносят содержащийся в них насыщенный пар к свободной поверхности жидкости. 12. Всплывшие пузырьки начинают лопаться, когда давление насыщенного пара внутри будет превосходить внешнее давление.
Процесс:
7. Увеличение объема пузырька: когда давление насыщенного пара внутри превосходит внешнее давление
8. Если глубина сосуда 1 м, то ρ ∙ g ∙ h < pa. Значит им можно пренебречь. 9. При увеличении температуры жидкости объем пузырька возрастает. Когда сила Архимеда становится больше силы тяжести и силы сцепления пузырька со стенкой, то пузырек всплывает. 10. Если пузырьки поднимаются в жидкости, имеющей постоянную температуру, то они увеличиваются в объеме в соответствии с законом Бойля-Мариотта, так как давление в верхних слоях жидкости уменьшается. 11. Всплывая, пузырьки переносят содержащийся в них насыщенный пар к свободной поверхности жидкости. 12. Всплывшие пузырьки начинают лопаться, когда давление насыщенного пара внутри будет превосходить внешнее давление.
Слайд 7
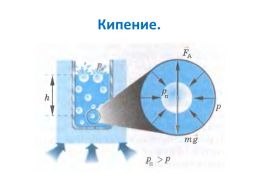
Кипение.
Слайд 8

Температура кипения.
Температура кипения – температура, при которой давление насыщенного пара жидкости начинает превосходить внешнее давление на жидкость.
Температура кипения зависит от внешнего давления на жидкость!!!
На высоте h = 5 км над уровнем моря tk (воды) = 83 °C, так как давление в 2 раза ниже атмосферного.
Эверест - tk (воды) = 74 °C
Температура кипения – температура, при которой давление насыщенного пара жидкости начинает превосходить внешнее давление на жидкость.
Температура кипения зависит от внешнего давления на жидкость!!!
На высоте h = 5 км над уровнем моря tk (воды) = 83 °C, так как давление в 2 раза ниже атмосферного.
Эверест - tk (воды) = 74 °C
Слайд 9
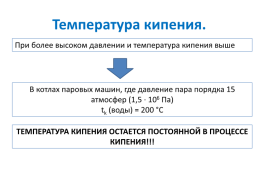
Температура кипения.
При более высоком давлении и температура кипения выше
В котлах паровых машин, где давление пара порядка 15 атмосфер (1,5 ∙ 106 Па) tk (воды) = 200 °C
ТЕМПЕРАТУРА КИПЕНИЯ ОСТАЕТСЯ ПОСТОЯННОЙ В ПРОЦЕССЕ КИПЕНИЯ!!!
При более высоком давлении и температура кипения выше
В котлах паровых машин, где давление пара порядка 15 атмосфер (1,5 ∙ 106 Па) tk (воды) = 200 °C
ТЕМПЕРАТУРА КИПЕНИЯ ОСТАЕТСЯ ПОСТОЯННОЙ В ПРОЦЕССЕ КИПЕНИЯ!!!
Слайд 10

Температура кипения.
Слайд 11

Температура кипения.
Жидкость, не содержащая газ (воздух) и находящаяся в сосуде, со стенок которого удален газ, не кипит.
Такая жидкость, нагретая до температуры, превышающей нормальную температуру кипения, называется перегретой.
Жидкость, не содержащая газ (воздух) и находящаяся в сосуде, со стенок которого удален газ, не кипит.
Такая жидкость, нагретая до температуры, превышающей нормальную температуру кипения, называется перегретой.
Слайд 12

Температура кипения.
Перегретая жидкость
Перегретая жидкость
Слайд 13

Задание!
Почему температура жидкости остается постоянной в процессе кипения?
Почему температура жидкости остается постоянной в процессе кипения?
Слайд 14
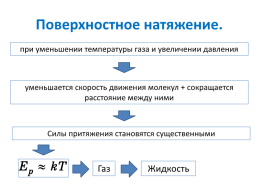
Поверхностное натяжение.
при уменьшении температуры газа и увеличении давления
уменьшается скорость движения молекул + сокращается расстояние между ними
Силы притяжения становятся существенными
Газ
Жидкость
при уменьшении температуры газа и увеличении давления
уменьшается скорость движения молекул + сокращается расстояние между ними
Силы притяжения становятся существенными
Газ
Жидкость
Слайд 15
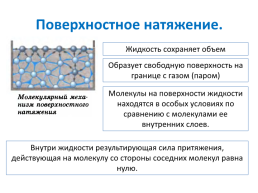
Поверхностное натяжение.
Жидкость сохраняет объем
Образует свободную поверхность на границе с газом (паром)
Молекулы на поверхности жидкости находятся в особых условиях по сравнению с молекулами ее внутренних слоев.
Внутри жидкости результирующая сила притяжения, действующая на молекулу со стороны соседних молекул равна нулю.
Жидкость сохраняет объем
Образует свободную поверхность на границе с газом (паром)
Молекулы на поверхности жидкости находятся в особых условиях по сравнению с молекулами ее внутренних слоев.
Внутри жидкости результирующая сила притяжения, действующая на молекулу со стороны соседних молекул равна нулю.
Слайд 16
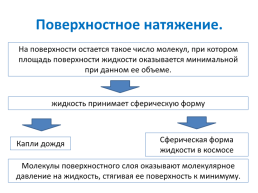
Поверхностное натяжение.
На поверхности остается такое число молекул, при котором площадь поверхности жидкости оказывается минимальной при данном ее объеме.
жидкость принимает сферическую форму
Сферическая форма жидкости в космосе
Капли дождя
Молекулы поверхностного слоя оказывают молекулярное давление на жидкость, стягивая ее поверхность к минимуму.
На поверхности остается такое число молекул, при котором площадь поверхности жидкости оказывается минимальной при данном ее объеме.
жидкость принимает сферическую форму
Сферическая форма жидкости в космосе
Капли дождя
Молекулы поверхностного слоя оказывают молекулярное давление на жидкость, стягивая ее поверхность к минимуму.
Слайд 17
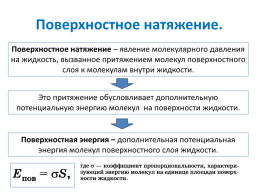
Поверхностное натяжение.
Поверхностное натяжение – явление молекулярного давления на жидкость, вызванное притяжением молекул поверхностного слоя к молекулам внутри жидкости.
Это притяжение обусловливает дополнительную потенциальную энергию молекул на поверхности жидкости.
Поверхностная энергия – дополнительная потенциальная энергия молекул поверхностного слоя жидкости.
Поверхностное натяжение – явление молекулярного давления на жидкость, вызванное притяжением молекул поверхностного слоя к молекулам внутри жидкости.
Это притяжение обусловливает дополнительную потенциальную энергию молекул на поверхности жидкости.
Поверхностная энергия – дополнительная потенциальная энергия молекул поверхностного слоя жидкости.
Слайд 18
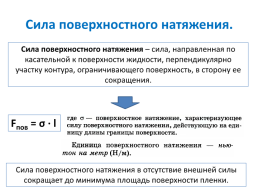
Сила поверхностного натяжения.
Сила поверхностного натяжения – сила, направленная по касательной к поверхности жидкости, перпендикулярно участку контура, ограничивающего поверхность, в сторону ее сокращения.
Fпов = σ ∙ l
Сила поверхностного натяжения в отсутствие внешней силы сокращает до минимума площадь поверхности пленки.
Сила поверхностного натяжения – сила, направленная по касательной к поверхности жидкости, перпендикулярно участку контура, ограничивающего поверхность, в сторону ее сокращения.
Fпов = σ ∙ l
Сила поверхностного натяжения в отсутствие внешней силы сокращает до минимума площадь поверхности пленки.
Слайд 19

Сила поверхностного натяжения.
Благодаря силе поверхностного натяжения по поверхности воды могут плавать легкие предметы и удерживаться водомерки.
Благодаря силе поверхностного натяжения по поверхности воды могут плавать легкие предметы и удерживаться водомерки.
Слайд 20

Сила поверхностного натяжения.
Чем меньше сила поверхностного натяжения, тем легче жидкость проникает в ткань и смачивает различные тела.
Чем меньше сила поверхностного натяжения, тем легче жидкость проникает в ткань и смачивает различные тела.
Слайд 21
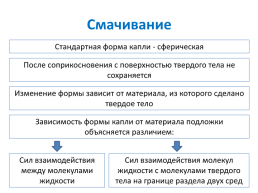
Смачивание
Стандартная форма капли - сферическая
После соприкосновения с поверхностью твердого тела не сохраняется
Изменение формы зависит от материала, из которого сделано твердое тело
Зависимость формы капли от материала подложки объясняется различием:
Сил взаимодействия между молекулами жидкости
Сил взаимодействия молекул жидкости с молекулами твердого тела на границе раздела двух сред
Стандартная форма капли - сферическая
После соприкосновения с поверхностью твердого тела не сохраняется
Изменение формы зависит от материала, из которого сделано твердое тело
Зависимость формы капли от материала подложки объясняется различием:
Сил взаимодействия между молекулами жидкости
Сил взаимодействия молекул жидкости с молекулами твердого тела на границе раздела двух сред
Слайд 22
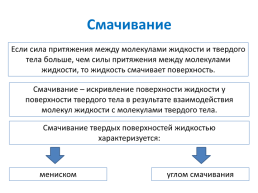
Смачивание
Если сила притяжения между молекулами жидкости и твердого тела больше, чем силы притяжения между молекулами жидкости, то жидкость смачивает поверхность.
Смачивание – искривление поверхности жидкости у поверхности твердого тела в результате взаимодействия молекул жидкости с молекулами твердого тела.
Смачивание твердых поверхностей жидкостью характеризуется:
мениском
углом смачивания
Если сила притяжения между молекулами жидкости и твердого тела больше, чем силы притяжения между молекулами жидкости, то жидкость смачивает поверхность.
Смачивание – искривление поверхности жидкости у поверхности твердого тела в результате взаимодействия молекул жидкости с молекулами твердого тела.
Смачивание твердых поверхностей жидкостью характеризуется:
мениском
углом смачивания
Слайд 23
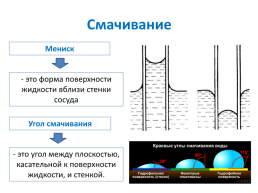
Смачивание
Мениск
- это форма поверхности жидкости вблизи стенки сосуда
Угол смачивания
- это угол между плоскостью, касательной к поверхности жидкости, и стенкой.
Мениск
- это форма поверхности жидкости вблизи стенки сосуда
Угол смачивания
- это угол между плоскостью, касательной к поверхности жидкости, и стенкой.
Слайд 24
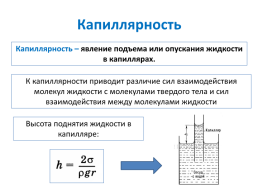
Капиллярность
Капиллярность – явление подъема или опускания жидкости в капиллярах.
К капиллярности приводит различие сил взаимодействия молекул жидкости с молекулами твердого тела и сил взаимодействия между молекулами жидкости
Высота поднятия жидкости в капилляре:
Капиллярность – явление подъема или опускания жидкости в капиллярах.
К капиллярности приводит различие сил взаимодействия молекул жидкости с молекулами твердого тела и сил взаимодействия между молекулами жидкости
Высота поднятия жидкости в капилляре:
Слайд 25

Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха.
http://eduquest.ucoz.ru
http://eduquest.ucoz.ru
Слайд 26

Понятие фазы вещества.
Если система разделяется на граничащие друг с другом однородные части, находящиеся в физически различных состояниях, то эти части называются фазами системы
Фазовое равновесие – состояние, в котором две или больше различных фаз вещества при данных температуре и давлении существуют одновременно, соприкасаясь друг с другом и если при этом масса одной из фаз не растет за счет другой.
Фазовый переход – переход вещества из одного состояния (фазы) в другое называется фазовым переходом.
Если система разделяется на граничащие друг с другом однородные части, находящиеся в физически различных состояниях, то эти части называются фазами системы
Фазовое равновесие – состояние, в котором две или больше различных фаз вещества при данных температуре и давлении существуют одновременно, соприкасаясь друг с другом и если при этом масса одной из фаз не растет за счет другой.
Фазовый переход – переход вещества из одного состояния (фазы) в другое называется фазовым переходом.
Слайд 27

Насыщенный пар
Процессы
испарение
конденсация
Насыщенный пар
- пар, находящийся в динамическом равновесии со своей жидкостью.
Динамическое равновесие – состояние, при котором число молекул, переходящих из жидкости в пар (испаряющихся) равно числу молекул, переходящих обратно в жидкость (конденсирующихся).
Процессы
испарение
конденсация
Насыщенный пар
- пар, находящийся в динамическом равновесии со своей жидкостью.
Динамическое равновесие – состояние, при котором число молекул, переходящих из жидкости в пар (испаряющихся) равно числу молекул, переходящих обратно в жидкость (конденсирующихся).
Слайд 28

Насыщенный пар
Давление насыщенного пара
- давление пара p0, при котором жидкость находится в равновесии со своим паром.
Давление насыщенного пара
- давление пара p0, при котором жидкость находится в равновесии со своим паром.
Слайд 29
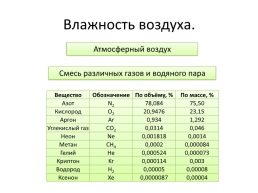
Влажность воздуха.
Атмосферный воздух
Смесь различных газов и водяного пара
Вещество.Обозначение.По объёму, %.По массе, %
Азот.N2.78,084.75,50
Кислород.O2.20,9476.23,15
Аргон.Ar.0,934.1,292
Углекислый газ.CO2.0,0314.0,046
Неон.Ne.0,001818.0,0014
Метан.CH4.0,0002.0,000084
Гелий.He.0,000524.0,000073
Криптон.Kr.0,000114.0,003
Водород.H2.0,00005.0,00008
Ксенон.Xe.0,0000087.0,00004
Атмосферный воздух
Смесь различных газов и водяного пара
Вещество.Обозначение.По объёму, %.По массе, %
Азот.N2.78,084.75,50
Кислород.O2.20,9476.23,15
Аргон.Ar.0,934.1,292
Углекислый газ.CO2.0,0314.0,046
Неон.Ne.0,001818.0,0014
Метан.CH4.0,0002.0,000084
Гелий.He.0,000524.0,000073
Криптон.Kr.0,000114.0,003
Водород.H2.0,00005.0,00008
Ксенон.Xe.0,0000087.0,00004
Слайд 30
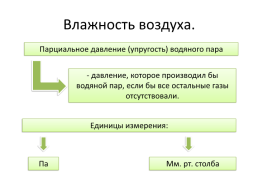
Влажность воздуха.
Парциальное давление (упругость) водяного пара
- давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали.
Единицы измерения:
Па
Мм. рт. столба
Парциальное давление (упругость) водяного пара
- давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали.
Единицы измерения:
Па
Мм. рт. столба
Слайд 31
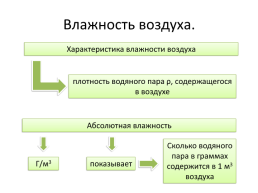
Влажность воздуха.
Характеристика влажности воздуха
плотность водяного пара ρ, содержащегося в воздухе
Абсолютная влажность
Сколько водяного пара в граммах содержится в 1 м3 воздуха
Г/м3
показывает
Характеристика влажности воздуха
плотность водяного пара ρ, содержащегося в воздухе
Абсолютная влажность
Сколько водяного пара в граммах содержится в 1 м3 воздуха
Г/м3
показывает
Слайд 32
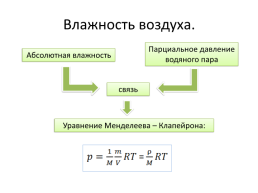
Влажность воздуха.
Парциальное давление водяного пара
Абсолютная влажность
связь
Уравнение Менделеева – Клапейрона:
Парциальное давление водяного пара
Абсолютная влажность
связь
Уравнение Менделеева – Клапейрона:
Слайд 33
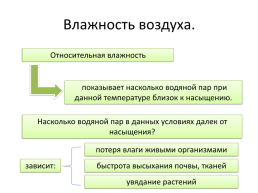
Влажность воздуха.
Относительная влажность
показывает насколько водяной пар при данной температуре близок к насыщению.
Насколько водяной пар в данных условиях далек от насыщения?
потеря влаги живыми организмами
зависит:
быстрота высыхания почвы, тканей
увядание растений
Относительная влажность
показывает насколько водяной пар при данной температуре близок к насыщению.
Насколько водяной пар в данных условиях далек от насыщения?
потеря влаги живыми организмами
зависит:
быстрота высыхания почвы, тканей
увядание растений
Слайд 34
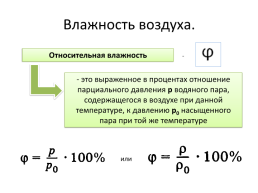
Влажность воздуха.
Относительная влажность
-
- это выраженное в процентах отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению p0 насыщенного пара при той же температуре
или
Относительная влажность
-
- это выраженное в процентах отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению p0 насыщенного пара при той же температуре
или
Слайд 35

Влажность воздуха.
Давление и плотность насыщенного водяного пара при разных температурах можно найти, воспользовавшись специальными таблицами, которые есть в справочниках или задачниках по физике:
Давление и плотность насыщенного водяного пара при разных температурах можно найти, воспользовавшись специальными таблицами, которые есть в справочниках или задачниках по физике:
Слайд 36
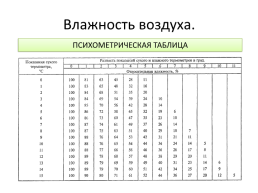
Влажность воздуха.
ПСИХОМЕТРИЧЕСКАЯ ТАБЛИЦА
ПСИХОМЕТРИЧЕСКАЯ ТАБЛИЦА
Слайд 37

Влажность воздуха.
ТОЧКА РОСЫ
- это температура, до которой должен охладиться воздух, чтобы находящийся в нем водяной пар достиг состояния насыщения (при данной влажности воздуха и неизменном давлении)
Давление насыщенного водяного пара при температуре воздуха, равной точке росы, и есть парциальное давление водяного пара, содержащегося в атмосфере.
При охлаждении воздуха до точки росы начинается конденсация паров: роса, туман
ТОЧКА РОСЫ
- это температура, до которой должен охладиться воздух, чтобы находящийся в нем водяной пар достиг состояния насыщения (при данной влажности воздуха и неизменном давлении)
Давление насыщенного водяного пара при температуре воздуха, равной точке росы, и есть парциальное давление водяного пара, содержащегося в атмосфере.
При охлаждении воздуха до точки росы начинается конденсация паров: роса, туман
Слайд 38
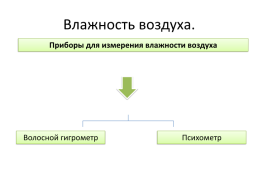
Влажность воздуха.
Приборы для измерения влажности воздуха
Волосной гигрометр
Психометр
Приборы для измерения влажности воздуха
Волосной гигрометр
Психометр
Слайд 39
Влажность воздуха.
Волосной гигрометр
Действие основано на свойстве обезжиренного человеческого волоса удлиняться при увеличении относительной влажности.
Волосной гигрометр
Действие основано на свойстве обезжиренного человеческого волоса удлиняться при увеличении относительной влажности.
Слайд 40
Влажность воздуха.
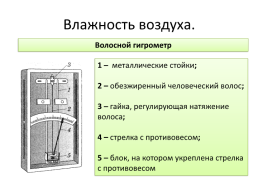
Волосной гигрометр
1 – металлические стойки; 2 – обезжиренный человеческий волос; 3 – гайка, регулирующая натяжение волоса; 4 – стрелка с противовесом; 5 – блок, на котором укреплена стрелка с противовесом
Волосной гигрометр
1 – металлические стойки; 2 – обезжиренный человеческий волос; 3 – гайка, регулирующая натяжение волоса; 4 – стрелка с противовесом; 5 – блок, на котором укреплена стрелка с противовесом
Слайд 41
Влажность воздуха.
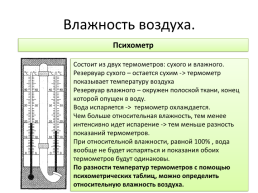
Психометр
Состоит из двух термометров: сухого и влажного. Резервуар сухого – остается сухим -> термометр показывает температуру воздуха Резервуар влажного – окружен полоской ткани, конец которой опущен в воду. Вода испаряется -> термометр охлаждается. Чем больше относительная влажность, тем менее интенсивно идет испарение -> тем меньше разность показаний термометров. При относительной влажности, равной 100% , вода вообще не будет испаряться и показания обоих термометров будут одинаковы. По разности температур термометров с помощью психометрических таблиц, можно определить относительную влажность воздуха.
Психометр
Состоит из двух термометров: сухого и влажного. Резервуар сухого – остается сухим -> термометр показывает температуру воздуха Резервуар влажного – окружен полоской ткани, конец которой опущен в воду. Вода испаряется -> термометр охлаждается. Чем больше относительная влажность, тем менее интенсивно идет испарение -> тем меньше разность показаний термометров. При относительной влажности, равной 100% , вода вообще не будет испаряться и показания обоих термометров будут одинаковы. По разности температур термометров с помощью психометрических таблиц, можно определить относительную влажность воздуха.
Слайд 42

Домашнее задание
Написать, что такое: Смачивание (примеры смачивания/несмачивания), мениск, угол смачивания, нарисовать и пояснить, какие бывают углы смачивания, капиллярность, примеры капиллярности, формулу для высоты поднятия жидкости в капилляре, от чего зависит высота подъема жидкости в капилляре
Написать, что такое: Смачивание (примеры смачивания/несмачивания), мениск, угол смачивания, нарисовать и пояснить, какие бывают углы смачивания, капиллярность, примеры капиллярности, формулу для высоты поднятия жидкости в капилляре, от чего зависит высота подъема жидкости в капилляре
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
