Презентация - Твердое состояние вещества. Плавление. Кристаллическое и аморфное состояние вещества. Типы связи в кристаллах
Нужно больше вариантов? Смотреть похожие Нажмите для полного просмотра 
|
Распечатать
- Уникальность: 99%
- Слайдов: 39
- Просмотров: 890
- Скачиваний: 68
- Размер: 1.86 MB
- Онлайн: Да
- Формат: ppt / pptx
Примеры похожих презентаций
 Агрегатные состояния вещества. Плавление и отвердевание кристалических тел. График плавления и отвердевания кристаллических тел.
Агрегатные состояния вещества. Плавление и отвердевание кристалических тел. График плавления и отвердевания кристаллических тел. Агрегатные состояния вещества. Плавление и отвердевание кристалических тел. График плавления и отвердевания кристаллических тел
Агрегатные состояния вещества. Плавление и отвердевание кристалических тел. График плавления и отвердевания кристаллических тел Изменение агрегатных состояний вещества. Плавление и отвердевание кристаллических тел
Изменение агрегатных состояний вещества. Плавление и отвердевание кристаллических тел Кристаллические и аморфные тела - Поверхностное натяжение жидкостей
Кристаллические и аморфные тела - Поверхностное натяжение жидкостей Типы связи слов в словосочетании. (Урок повторения и подготовки к ЕГЭ). Подчинительные словосочетания
Типы связи слов в словосочетании. (Урок повторения и подготовки к ЕГЭ). Подчинительные словосочетания Изменение агрегатного состояния вещества
Изменение агрегатного состояния вещества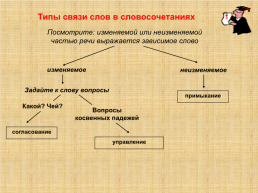 Типы связи слов в словосочетаниях
Типы связи слов в словосочетаниях
Слайды и текст этой онлайн презентации
Слайд 1

Твердое состояние вещества. Плавление. Кристаллическое и аморфное состояние вещества. Типы связи в кристаллах.
http://eduquest.ucoz.ru
http://eduquest.ucoz.ru
Слайд 2
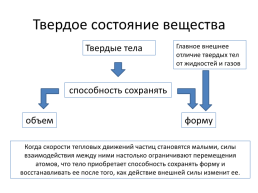
Твердое состояние вещества
Главное внешнее отличие твердых тел от жидкостей и газов
Твердые тела
способность сохранять
объем
форму
Когда скорости тепловых движений частиц становятся малыми, силы взаимодействия между ними настолько ограничивают перемещения атомов, что тело приобретает способность сохранять форму и восстанавливать ее после того, как действие внешней силы изменит ее.
Главное внешнее отличие твердых тел от жидкостей и газов
Твердые тела
способность сохранять
объем
форму
Когда скорости тепловых движений частиц становятся малыми, силы взаимодействия между ними настолько ограничивают перемещения атомов, что тело приобретает способность сохранять форму и восстанавливать ее после того, как действие внешней силы изменит ее.
Слайд 3
Твердое состояние вещества
Твердые тела
тела, которые обладают постоянством формы и объема
Твердые тела
тела, которые обладают постоянством формы и объема
Слайд 4
Твердое состояние вещества
Твердые тела
повышение температуры
переход
Жидкое состояние
Твердые тела
повышение температуры
переход
Жидкое состояние
Слайд 5
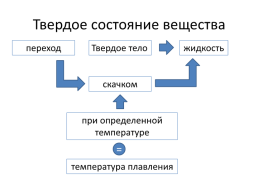
Твердое состояние вещества
переход
Твердое тело
жидкость
скачком
при определенной температуре
=
температура плавления
переход
Твердое тело
жидкость
скачком
при определенной температуре
=
температура плавления
Слайд 6
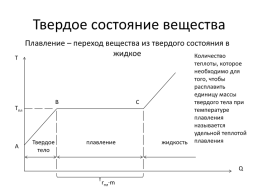
Твердое состояние вещества
Плавление – переход вещества из твердого состояния в жидкое
Количество теплоты, которое необходимо для того, чтобы расплавить единицу массы твердого тела при температуре плавления называется удельной теплотой плавления
Т
B
C
Тпл
Твердое тело
плавление
жидкость
А
Q
rпл∙m
Плавление – переход вещества из твердого состояния в жидкое
Количество теплоты, которое необходимо для того, чтобы расплавить единицу массы твердого тела при температуре плавления называется удельной теплотой плавления
Т
B
C
Тпл
Твердое тело
плавление
жидкость
А
Q
rпл∙m
Слайд 7
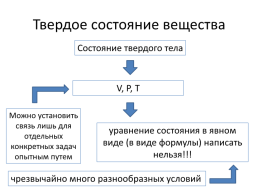
Твердое состояние вещества
Состояние твердого тела
V, P, T
Можно установить связь лишь для отдельных конкретных задач опытным путем
уравнение состояния в явном виде (в виде формулы) написать нельзя!!!
чрезвычайно много разнообразных условий
Состояние твердого тела
V, P, T
Можно установить связь лишь для отдельных конкретных задач опытным путем
уравнение состояния в явном виде (в виде формулы) написать нельзя!!!
чрезвычайно много разнообразных условий
Слайд 8
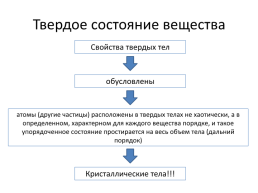
Твердое состояние вещества
Свойства твердых тел
обусловлены
атомы (другие частицы) расположены в твердых телах не хаотически, а в определенном, характерном для каждого вещества порядке, и такое упорядоченное состояние простирается на весь объем тела (дальний порядок)
Кристаллические тела!!!
Свойства твердых тел
обусловлены
атомы (другие частицы) расположены в твердых телах не хаотически, а в определенном, характерном для каждого вещества порядке, и такое упорядоченное состояние простирается на весь объем тела (дальний порядок)
Кристаллические тела!!!
Слайд 9
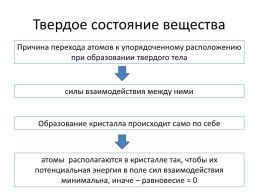
Твердое состояние вещества
Причина перехода атомов к упорядоченному расположению при образовании твердого тела
силы взаимодействия между ними
Образование кристалла происходит само по себе
атомы располагаются в кристалле так, чтобы их потенциальная энергия в поле сил взаимодействия минимальна, иначе – равновесие = 0
Причина перехода атомов к упорядоченному расположению при образовании твердого тела
силы взаимодействия между ними
Образование кристалла происходит само по себе
атомы располагаются в кристалле так, чтобы их потенциальная энергия в поле сил взаимодействия минимальна, иначе – равновесие = 0
Слайд 10
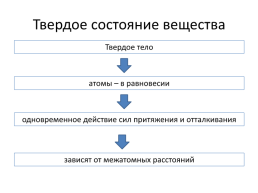
Твердое состояние вещества
Твердое тело
атомы – в равновесии
одновременное действие сил притяжения и отталкивания
зависят от межатомных расстояний
Твердое тело
атомы – в равновесии
одновременное действие сил притяжения и отталкивания
зависят от межатомных расстояний
Слайд 11
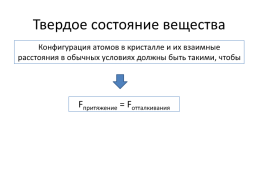
Твердое состояние вещества
Конфигурация атомов в кристалле и их взаимные расстояния в обычных условиях должны быть такими, чтобы
Fпритяжение = Fотталкивания
Конфигурация атомов в кристалле и их взаимные расстояния в обычных условиях должны быть такими, чтобы
Fпритяжение = Fотталкивания
Слайд 12
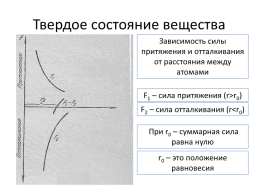
Твердое состояние вещества
Зависимость силы притяжения и отталкивания от расстояния между атомами
F1 – сила притяжения (r>r0)
F2 – сила отталкивания (r
r0 – это положение равновесия
Зависимость силы притяжения и отталкивания от расстояния между атомами
F1 – сила притяжения (r>r0)
F2 – сила отталкивания (r
r0 – это положение равновесия
Слайд 13

Кристаллические тела
кристаллы поваренной соли
кристаллы сахара
Наличие граней – признак нахождения вещества в кристаллическом состоянии.
кристаллы медного купороса
Все они ограничены плоскими гранями!!!
кристаллы поваренной соли
кристаллы сахара
Наличие граней – признак нахождения вещества в кристаллическом состоянии.
кристаллы медного купороса
Все они ограничены плоскими гранями!!!
Слайд 14

Кристаллические тела
Кристаллом называется тело определенной геометрической формы, ограниченное естественными плоскими гранями.
Кристаллом называется тело определенной геометрической формы, ограниченное естественными плоскими гранями.
Слайд 15

Монокристалл
Тело, представляющее собой один кристалл, называется монокристаллом.
К монокристаллам относятся природные кристаллы: кварц, алмаз, турмалин, крупинки соли, сахара, соды.
Монокристалл кварца
Искусственный монокристалл алмаза
Тело, представляющее собой один кристалл, называется монокристаллом.
К монокристаллам относятся природные кристаллы: кварц, алмаз, турмалин, крупинки соли, сахара, соды.
Монокристалл кварца
Искусственный монокристалл алмаза
Слайд 16

Поликристаллы
Тело, состоящее из множества сросшихся между собой мелких кристалликов, называется поликристаллическим (поликристаллом)
Поликристалл кремния
Поликристалл сахара
Тело, состоящее из множества сросшихся между собой мелких кристалликов, называется поликристаллическим (поликристаллом)
Поликристалл кремния
Поликристалл сахара
Слайд 17
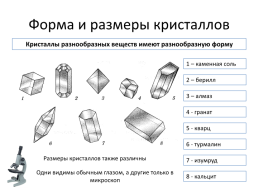
Форма и размеры кристаллов
Кристаллы разнообразных веществ имеют разнообразную форму
1 – каменная соль
2 – берилл
3 – алмаз
4 - гранат
5 - кварц
6 - турмалин
Размеры кристаллов также различны
7 - изумруд
Одни видимы обычным глазом, а другие только в микроскоп
8 - кальцит
Кристаллы разнообразных веществ имеют разнообразную форму
1 – каменная соль
2 – берилл
3 – алмаз
4 - гранат
5 - кварц
6 - турмалин
Размеры кристаллов также различны
7 - изумруд
Одни видимы обычным глазом, а другие только в микроскоп
8 - кальцит
Слайд 18
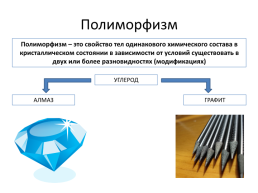
Полиморфизм
Полиморфизм – это свойство тел одинакового химического состава в кристаллическом состоянии в зависимости от условий существовать в двух или более разновидностях (модификациях)
УГЛЕРОД
АЛМАЗ
ГРАФИТ
Полиморфизм – это свойство тел одинакового химического состава в кристаллическом состоянии в зависимости от условий существовать в двух или более разновидностях (модификациях)
УГЛЕРОД
АЛМАЗ
ГРАФИТ
Слайд 19
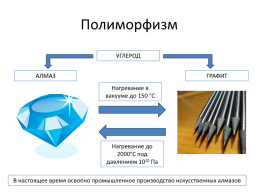
Полиморфизм
УГЛЕРОД
АЛМАЗ
ГРАФИТ
Нагревание в вакууме до 150 °С
Нагревание до 2000°С под давлением 1010 Па
В настоящее время освоено промышленное производство искусственных алмазов
УГЛЕРОД
АЛМАЗ
ГРАФИТ
Нагревание в вакууме до 150 °С
Нагревание до 2000°С под давлением 1010 Па
В настоящее время освоено промышленное производство искусственных алмазов
Слайд 20

Полиморфизм
У льда известно 14 различных модификаций, которые получают в лабораториях:
Впервые полиморфизм льда был обнаружен Г. Тамманом в 1900 г. и подробно изучен П. Бриджменом в 1912 г.
У льда известно 14 различных модификаций, которые получают в лабораториях:
Впервые полиморфизм льда был обнаружен Г. Тамманом в 1900 г. и подробно изучен П. Бриджменом в 1912 г.
Слайд 21

Полиморфизм
Родился в 1861 году. Окончив гимназию в Дерпте, Тамман поступил на физико-математический факультет Дерптского университета, по окончании курса которого в 1882 году состоял лаборантом при химической лаборатории, затем, с 1887 года, был приват-доцентом, впоследствии штатным доцентом и с 1892 года профессором и директором химической лаборатории того же университета. C 1903 года работал в Гёттингенском университете.
Густав Генрихович Тамман 09 июня 1861 - 17 декабря 1938
Родился в 1861 году. Окончив гимназию в Дерпте, Тамман поступил на физико-математический факультет Дерптского университета, по окончании курса которого в 1882 году состоял лаборантом при химической лаборатории, затем, с 1887 года, был приват-доцентом, впоследствии штатным доцентом и с 1892 года профессором и директором химической лаборатории того же университета. C 1903 года работал в Гёттингенском университете.
Густав Генрихович Тамман 09 июня 1861 - 17 декабря 1938
Слайд 22

Полиморфизм
Американский физик, лауреат Нобелевской премии по физике в 1946 году «за изобретение прибора, позволяющего создавать сверхвысокие давления, и за открытия, сделанные в связи с этим в физике высоких давлений». Бриджмен родился в Кембридже, в США. Он поступил в Гарвардский университет в 1900 г., изучал там физику и с 1910 г. преподавал в Гарварде, с 1919 г. в качестве профессора. В 1905 г. он начал исследования некоторых явлений при высоких давлениях. Изобретатель установки, позволявшей получать давления до 100 тысяч атмосфер. При помощи новой установки было исследовано множество новых явлений, включая влияние давления на электрическое сопротивление, а также поведение жидкостей и твёрдых тел при высоких давлениях. Также Бриджмен известен своими исследованиями электрической проводимости металлов и свойств кристаллов.
Перси Уильямс Бриджмен 21 апреля 1882 - 20 августа 1961
Американский физик, лауреат Нобелевской премии по физике в 1946 году «за изобретение прибора, позволяющего создавать сверхвысокие давления, и за открытия, сделанные в связи с этим в физике высоких давлений». Бриджмен родился в Кембридже, в США. Он поступил в Гарвардский университет в 1900 г., изучал там физику и с 1910 г. преподавал в Гарварде, с 1919 г. в качестве профессора. В 1905 г. он начал исследования некоторых явлений при высоких давлениях. Изобретатель установки, позволявшей получать давления до 100 тысяч атмосфер. При помощи новой установки было исследовано множество новых явлений, включая влияние давления на электрическое сопротивление, а также поведение жидкостей и твёрдых тел при высоких давлениях. Также Бриджмен известен своими исследованиями электрической проводимости металлов и свойств кристаллов.
Перси Уильямс Бриджмен 21 апреля 1882 - 20 августа 1961
Слайд 23
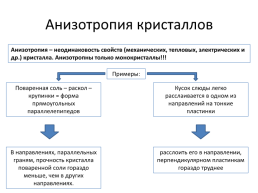
Анизотропия кристаллов
Анизотропия – неодинаковость свойств (механических, тепловых, электрических и др.) кристалла. Анизотропны только монокристаллы!!!
Примеры:
Поваренная соль – раскол – крупинки = форма прямоугольных параллелепипедов
Кусок слюды легко расслаивается в одном из направлений на тонкие пластинки
В направлениях, параллельных граням, прочность кристалла поваренной соли гораздо меньше, чем в других направлениях.
расслоить его в направлении, перпендикулярном пластинкам гораздо труднее
Анизотропия – неодинаковость свойств (механических, тепловых, электрических и др.) кристалла. Анизотропны только монокристаллы!!!
Примеры:
Поваренная соль – раскол – крупинки = форма прямоугольных параллелепипедов
Кусок слюды легко расслаивается в одном из направлений на тонкие пластинки
В направлениях, параллельных граням, прочность кристалла поваренной соли гораздо меньше, чем в других направлениях.
расслоить его в направлении, перпендикулярном пластинкам гораздо труднее
Слайд 24
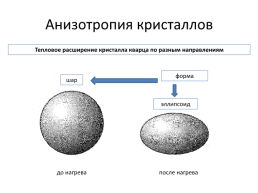
Анизотропия кристаллов
Тепловое расширение кристалла кварца по разным направлениям
форма
шар
эллипсоид
до нагрева
после нагрева
Тепловое расширение кристалла кварца по разным направлениям
форма
шар
эллипсоид
до нагрева
после нагрева
Слайд 25
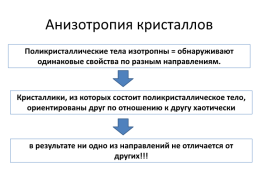
Анизотропия кристаллов
Поликристаллические тела изотропны = обнаруживают одинаковые свойства по разным направлениям.
Кристаллики, из которых состоит поликристаллическое тело, ориентированы друг по отношению к другу хаотически
в результате ни одно из направлений не отличается от других!!!
Поликристаллические тела изотропны = обнаруживают одинаковые свойства по разным направлениям.
Кристаллики, из которых состоит поликристаллическое тело, ориентированы друг по отношению к другу хаотически
в результате ни одно из направлений не отличается от других!!!
Слайд 26
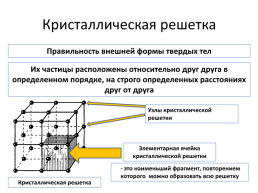
Кристаллическая решетка
Правильность внешней формы твердых тел
Их частицы расположены относительно друг друга в определенном порядке, на строго определенных расстояниях друг от друга
Узлы кристаллической решетки
Элементарная ячейка кристаллической решетки
- это наименьший фрагмент, повторением которого можно образовать всю решетку
Кристаллическая решетка
Правильность внешней формы твердых тел
Их частицы расположены относительно друг друга в определенном порядке, на строго определенных расстояниях друг от друга
Узлы кристаллической решетки
Элементарная ячейка кристаллической решетки
- это наименьший фрагмент, повторением которого можно образовать всю решетку
Кристаллическая решетка
Слайд 27
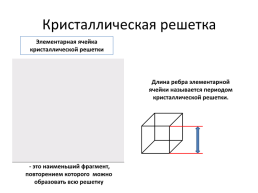
Кристаллическая решетка
Элементарная ячейка кристаллической решетки
Длина ребра элементарной ячейки называется периодом кристаллической решетки.
- это наименьший фрагмент, повторением которого можно образовать всю решетку
Элементарная ячейка кристаллической решетки
Длина ребра элементарной ячейки называется периодом кристаллической решетки.
- это наименьший фрагмент, повторением которого можно образовать всю решетку
Слайд 28
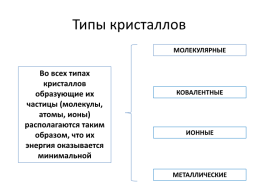
Типы кристаллов
МОЛЕКУЛЯРНЫЕ
Во всех типах кристаллов образующие их частицы (молекулы, атомы, ионы) располагаются таким образом, что их энергия оказывается минимальной
КОВАЛЕНТНЫЕ
ИОННЫЕ
МЕТАЛЛИЧЕСКИЕ
МОЛЕКУЛЯРНЫЕ
Во всех типах кристаллов образующие их частицы (молекулы, атомы, ионы) располагаются таким образом, что их энергия оказывается минимальной
КОВАЛЕНТНЫЕ
ИОННЫЕ
МЕТАЛЛИЧЕСКИЕ
Слайд 29
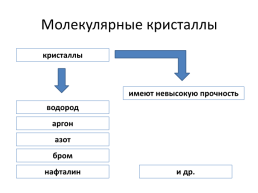
Молекулярные кристаллы
кристаллы
имеют невысокую прочность
водород
аргон
азот
бром
нафталин
и др.
кристаллы
имеют невысокую прочность
водород
аргон
азот
бром
нафталин
и др.
Слайд 30
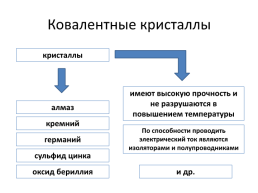
Ковалентные кристаллы
кристаллы
имеют высокую прочность и не разрушаются в повышением температуры
алмаз
кремний
По способности проводить электрический ток являются изоляторами и полупроводниками
германий
сульфид цинка
оксид бериллия
и др.
кристаллы
имеют высокую прочность и не разрушаются в повышением температуры
алмаз
кремний
По способности проводить электрический ток являются изоляторами и полупроводниками
германий
сульфид цинка
оксид бериллия
и др.
Слайд 31
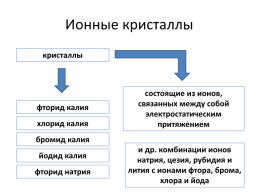
Ионные кристаллы
кристаллы
состоящие из ионов, связанных между собой электростатическим притяжением
фторид калия
хлорид калия
бромид калия
и др. комбинации ионов натрия, цезия, рубидия и лития с ионами фтора, брома, хлора и йода
йодид калия
фторид натрия
кристаллы
состоящие из ионов, связанных между собой электростатическим притяжением
фторид калия
хлорид калия
бромид калия
и др. комбинации ионов натрия, цезия, рубидия и лития с ионами фтора, брома, хлора и йода
йодид калия
фторид натрия
Слайд 32
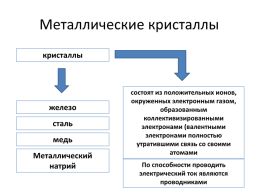
Металлические кристаллы
кристаллы
состоят из положительных ионов, окруженных электронным газом, образованным коллективизированными электронами (валентными электронами полностью утратившими связь со своими атомами
железо
сталь
медь
Металлический натрий
По способности проводить электрический ток являются проводниками
кристаллы
состоят из положительных ионов, окруженных электронным газом, образованным коллективизированными электронами (валентными электронами полностью утратившими связь со своими атомами
железо
сталь
медь
Металлический натрий
По способности проводить электрический ток являются проводниками
Слайд 33
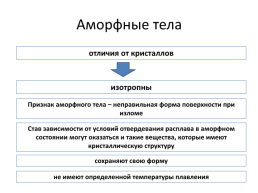
Аморфные тела
отличия от кристаллов
изотропны
Признак аморфного тела – неправильная форма поверхности при изломе
Став зависимости от условий отвердевания расплава в аморфном состоянии могут оказаться и такие вещества, которые имеют кристаллическую структуру
сохраняют свою форму
не имеют определенной температуры плавления
отличия от кристаллов
изотропны
Признак аморфного тела – неправильная форма поверхности при изломе
Став зависимости от условий отвердевания расплава в аморфном состоянии могут оказаться и такие вещества, которые имеют кристаллическую структуру
сохраняют свою форму
не имеют определенной температуры плавления
Слайд 34
Аморфные тела
сходство с жидкостями
По прошествии длительного промежутка времени изменяют свою форму
Например, под действием силы тяжести
сходство с жидкостями
По прошествии длительного промежутка времени изменяют свою форму
Например, под действием силы тяжести
Слайд 35

Аморфные тела
Аморфное состояние
неустойчивое
С течением времени вещество из аморфного состояния переходит в кристаллическое
Стекловидный аморфный сахарный леденец со временем засахаривается – покрывается кристаллами сахара
Аморфное состояние
неустойчивое
С течением времени вещество из аморфного состояния переходит в кристаллическое
Стекловидный аморфный сахарный леденец со временем засахаривается – покрывается кристаллами сахара
Слайд 36

Задание
1. Дайте характеристику кристаллическому состоянию вещества
2. Дайте характеристику аморфному состоянию вещества.
1. Дайте характеристику кристаллическому состоянию вещества
2. Дайте характеристику аморфному состоянию вещества.
Слайд 37

Задания
0,5 балла за 1 задачу. 1 балл – «2», 2 балла – «3», 2,5 балла – «4», 3 балла – «5»
Почему не изменяется температура кристаллических тел при плавлении или отвердевании? Во сколько раз больше требуется энергии для плавления льда при температуре 0˚С, чем для нагревания льда той же массы на 1˚С? Какое количество льда, взятого при температуре плавления, можно растопить, затратив энергию 340 Дж? Болванки из алюминия и серого чугуна одинаковой массы нагреты до температуры их плавления. Для плавления какого из тел потребуется больше энергии? Во сколько раз? Алюминиевый и медный бруски массой 1 кг каждый нагреты до температуры их плавления. Для плавления какого тела потребуется большее количество теплоты? На сколько большее? Какое количество теплоты поглощает при плавлении кусок свинца массой 1 г, начальная температура которого 27 ˚С; олова массой 10 г, взятого при температуре 32 ˚С?
0,5 балла за 1 задачу. 1 балл – «2», 2 балла – «3», 2,5 балла – «4», 3 балла – «5»
Почему не изменяется температура кристаллических тел при плавлении или отвердевании? Во сколько раз больше требуется энергии для плавления льда при температуре 0˚С, чем для нагревания льда той же массы на 1˚С? Какое количество льда, взятого при температуре плавления, можно растопить, затратив энергию 340 Дж? Болванки из алюминия и серого чугуна одинаковой массы нагреты до температуры их плавления. Для плавления какого из тел потребуется больше энергии? Во сколько раз? Алюминиевый и медный бруски массой 1 кг каждый нагреты до температуры их плавления. Для плавления какого тела потребуется большее количество теплоты? На сколько большее? Какое количество теплоты поглощает при плавлении кусок свинца массой 1 г, начальная температура которого 27 ˚С; олова массой 10 г, взятого при температуре 32 ˚С?
Слайд 38

Справочные данные
Слайд 39
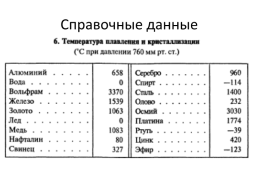
Справочные данные
^ Наверх
X
Благодарим за оценку!
Мы будем признательны, если Вы так же поделитесь этой презентацией со своими друзьями и подписчиками.
